Kostenlos: der ÄFI-Newsletter
Bleiben Sie auf dem Laufenden beim Thema
Impfungen & Impfentscheidung und rund um den Verein.
Tetanus (Wundstarrkrampf)
Welcher Erreger ist für die Krankheit verantwortlich? Warum ist Tetanus in Entwicklungsländern, nicht aber in Industrieländern ein gesundheitliches Problem? Gibt es effektive Therapiemöglichkeiten? Wird die Impfung nur zur Prävention oder auch als als Therapie eingesetzt? Was sind die häufigsten Nebenwirkungen? Worin unterscheiden sich die Empfehlungen der STIKO und der WHO? Antworten auf diese und weitere Fragen finden Sie im nachfolgenden Fachbeitrag.
Vorbemerkung
Die folgenden Ausführungen dienen der Information und ersetzen keinesfalls das ärztliche Beratungsgespräch. Hier werden Fakten präsentiert, die Eltern wie auch Ärztinnen und Ärzten in einem Aufklärungsgespräch helfen können. Ärztinnen und Ärzte für individuelle Impfentscheidung e. V. (ÄFI) übernimmt keine Garantie für Vollständigkeit, hat die hier verfügbaren Inhalte jedoch nach bestem Wissen und Gewissen am aktuellen Fach- und Sachstand zusammengetragen. Über die wissenschaftliche Arbeit des Vereins erfahren Sie hier mehr. Der Fachbeitrag wird jährlich aktualisiert. Das dargelegte Wissen entspricht dem Kenntnisstand zum angegebenen Veröffentlichungs- bzw. Aktualisierungsdatum. Weitere Informationen erhalten Sie auch in unserem Podcast.
Im Podcast anhören
Fachbeitrag
- Tetanus: Die Erkrankung
Erreger
- Clostridium tetani (C. tetani), ein stäbchenförmiges grampositives und anaerobes (sich nur unter Ausschluss von Sauerstoff vermehrendes) Bakterium, das Endosporen ausbildet.
- C. tetani bildet das Exotoxin Tetanospasmin aus – nach Botulinustoxin das zweitstärkste bekannte Gift, das von Bakterien produziert wird. Außerdem bildet es das Toxin Tetanolysin aus, wobei nur Ersteres das typische klinische Bild des Tetanus hervorruft.
- C. tetani kommt weltweit in der Erde, Staub und Kot vor, kann sich aber besonders gut in heißen und feuchten Klimazonen verbreiten, in denen im Boden viele organische Stoffe vorkommen.
- Tetanussporen sind widerstandsfähig und können auch extreme Hitze und Kälte sowie Desinfektionsmittel überleben. Ohne direkte Sonneneinstrahlung können sie in der Erde mehrere Jahre überstehen.
- Insgesamt sind 209 Clostridium Arten und 5 Subspezies bekannt. Es gibt auch nicht toxinproduzierende Formen von C. tetani.
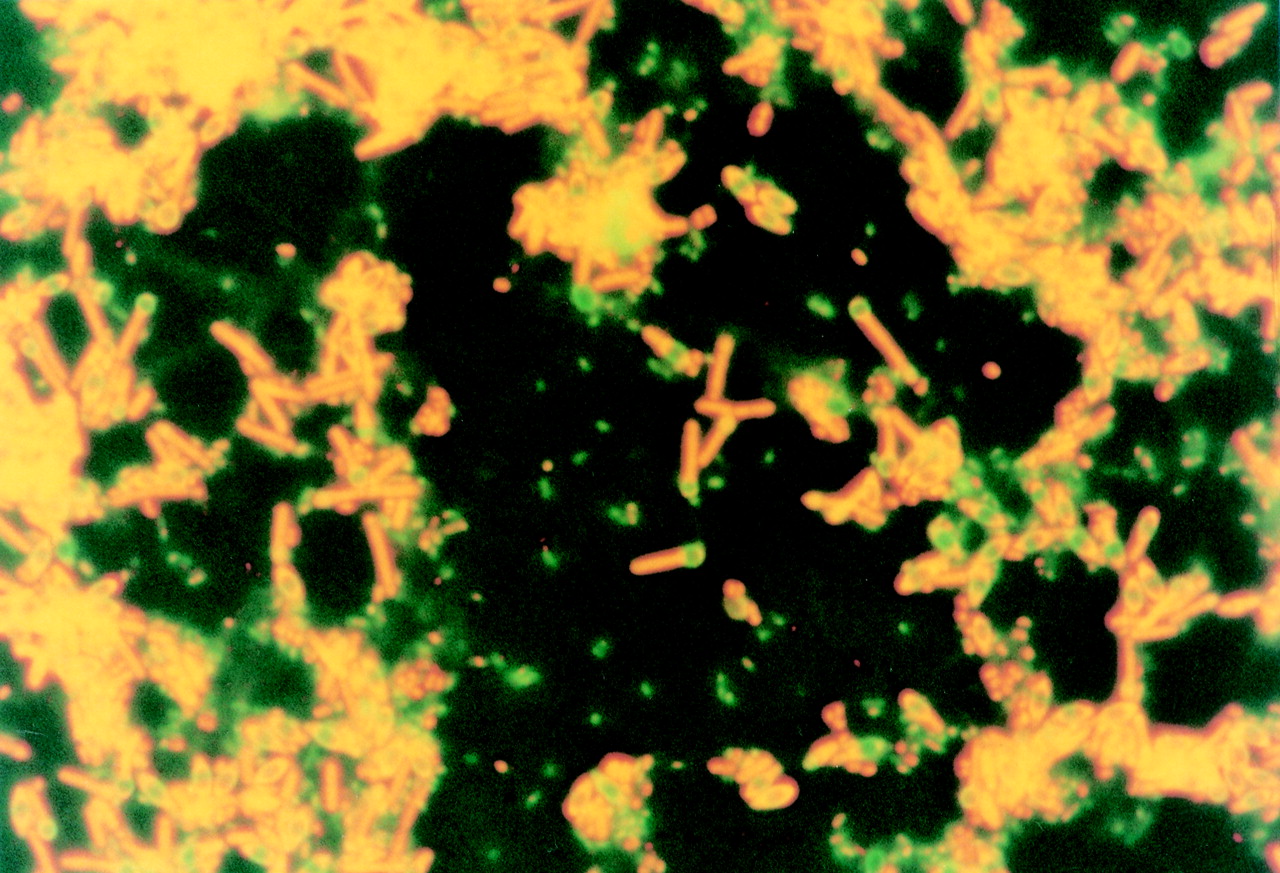
Abbildung 1: Acridinorange-Färbung des charakteristischen C tetani mit Endosporen (Farrar et al., 2000). Nutzungsgenehmigung durch das BMJ.
(Robert Koch-Institut, 2018; Bae & Bourget, 2022; George et al., 2023)
Infektionsmodus
- Voraussetzung für eine Infektion mit Tetanus ist eine Wunde. Die Sporen gelangen meist durch Fremdkörper wie Splitter, Nägel oder Dornen unter die Haut (Robert Koch-Institut, 2018).
- Grundsätzlich gilt, dass auch Bagatellverletzungen (z. B. leichte Wunden, die keine oder nur sehr geringe medizinische Hilfe benötigen und auch nicht verschmutzt sind) zu einer Tetanus-Erkrankung führen können.
- Bei bis zu 30 % der Patienten sind keine Eintrittspforten für Tetanus erkennbar (Thwaites & Farrar, 2003).
- Es sind auch Fälle nach Hautrissen, Insektenstichen, Zahninfektionen, Hundebissen, Brandverletzungen, Abszessen nach chirurgischen Eingriffen oder intravenösem Drogenmissbrauch bekannt (Bae & Bourget, 2022; George et al., 2023).
- Neugeborenen-Tetanus (Tetanus neonatorum) ist häufig in Entwicklungsländern die Folge einer Hausgeburt mit unhygienischer Durchtrennung oder fehlender Pflege der Nabelschnur (European Centre for Disease Prevention and Control, 2010; George et al., 2023).
- Eine Mensch-zu-Mensch-Übertragung ist nicht möglich, daher spielt die Herdenimmunität bei dieser Impfung keine Rolle (Wassilak et al., 2008).
- Die Inkubationszeit liegt bei durchschnittlich 8 Tagen, kann aber zwischen 3 und 21 Tagen variieren (George et al., 2023). Bei Neugeborenen-Tetanus ist die Inkubationszeit mit den ersten 3-14 Lebenstagen kürzer, am häufigsten tritt es an Tag 6 bis 8 auf (European Centre for Disease Prevention and Control, 2010).
Infektionsverlauf
Bei Tetanus werden drei Formen unterschieden: die generalisierte, neonatale und lokale Erkrankung (Robert Koch-Institut, 2018).
- Die Fallsterblichkeit wird von der WHO bei den drei Formen recht unterschiedlich angegeben, unter anderem abhängig von der Behandlung, dem Alter und der generellen Gesundheit des Patienten: 1 % für die lokale, 15 bis 30 % für die neonatale und 10 bis 70 % für die generalisierte Erkrankung (World Health Organization, 2017).
- Die weltweit häufigste neonatale Form bei Kindern verläuft wie die generalisierte Form mit Rigidität, Trinkschwäche und Krämpfen.
- Die aufgrund von Teilimmunität sehr selten entstehende lokale Form beschränkt sich in den Auswirkungen auf die Muskulatur in der Nähe der Eintrittsstelle des Bakteriums.
- Die amerikanische CDC gibt an, dass eine Tetanus-Erkrankung nicht zu einer Immunität vor erneuter Infektion führt (Centers for Disease Control and Prevention, 2022). Jedoch zeigten Veronesi et al. bereits 1975 auf, dass es sich dabei um eine Fehlinterpretation handeln dürfte: Beim Vorliegen geeigneter Bedingungen stimuliert das Tetanustoxin nachweisbar (durch 59 untersuchte Personen, die nie ein Tetanus-Toxoid oder ein entsprechendes Medikament erhalten haben) das Immunsystem und führt zur Ausbildung humoraler Antikörper. Bisher unbeantwortete Fragen könnten so geklärt werden:
- „Weshalb eine relativ geringe Anzahl von klinisch offensichtlichen Fällen bei Menschen und Tieren, die in großen Tetanus-Risikoregionen auf der ganzen Welt geboren wurden und leben, auftreten.
- Warum es «poor responders» und «good responders» beim primären Tetanus-Toxoid-Stimulus gibt.
- Weshalb die Altersverteilung von Tetanus eine deutliche Prävalenz bei Neugeborenen und Kindern zeigt
- Wieso es große individuelle Unterschiede im klinischen Bild von Tetanus beim Menschen gibt, die sich in der Lokalisierung und Begrenzung der Symptome sowie deren Schweregrad zeigen.“ (Übersetzung des Verfassers; Veronesi et al., 1975).
Weitere Untersuchungen, vor allem anhand von isolierten Gemeinschaften, deren Mitglieder bis zu 98 % messbare Antikörper aufwiesen, stützen die Idee der natürlichen Immunität. Aber es bleibt weiterhin die Frage offen, ob die durch den (mehrmaligen) Antigenkontakt mit C. tetani erreichte humorale Immunantwort ausreichend ist, um vor der Erkrankung zu schützen (Matzkin & Regev, 1985; Leshem & Herman, 1989).
Pathogenese & Komplikationen
Die generalisierte Form einer Tetanus-Erkrankung lässt sich wie folgt beschreiben:
- Bei der Kontamination von Wunden vermehren sich die Sporen von C. tetani, sofern anaerobe (sauerstofffreie) Bedingungen bestehen, und das Bakterium produziert die Exotoxine Tetanospasmin und Tetanolysin (Robert Koch-Institut, 2018).
- Tetanospasmin wird als Erstes in die Nervenenden der Motoneuronen aufgenommen (peripheres Nervensystem), wo es die Freisetzung des Neurotransmitters Acetylcholin beeinträchtigen kann. Deshalb ist eines der ersten Symptome die schlaffe Lähmung (Hassel, 2013; George et al., 2023).
- Weiterhin wird das Toxin retrograd zum zentralen Nervensystem transportiert und erreicht somit das Rückenmark und/oder den Hirnstamm. Dort löst es über die Hemmung der Neurotransmitter Gamma-Aminobuttersäure (GABA) und Glycin die typischen Wundstarrkrampf-Symptome aus (George et al., 2023).
- Es kommt über die unteren Motoneuronen zu einer Hyperaktivität mit unwillkürlicher Kontraktion (z. B. Steifheit, Spasmen) der Skelettmuskulatur, die Knochenbrüche und Muskelrisse zur Folge haben kann (Hassel, 2013; Bae & Bourget, 2022).
- Die Patienten weisen dabei einen charakteristischen Gesichtsausdruck, den das RKI als fixiertes Lächeln – Risus sardonicus – angibt. Weiterhin möglich sind Kieferklemme (Trismus), Schluckstörung (Dysphagie) und eine durch Atemnot verursachte Verkrampfung der Stimmlippenmuskeln (Laryngospasmus). Während die Extremitäten meist nicht betroffen sind, können mehrere Muskelgruppen gleichzeitig schmerzhaft kontrahieren (Robert Koch-Institut, 2018).
- Respiratorische Komplikationen wie Pneumonien können eine Ateminsuffizienz verursachen. Weitere lebensbedrohliche Komplikationen sind Lungenentzündung durch Aspiration, Rhabdomyolyse mit drohendem Nierenversagen, obere gastrointestinale Blutungen, kardiovaskuläre Instabilität wie vorübergehender Herzstillstand, Tachykardie oder Bradykardie, Arrhythmien, Bluthochdruck, akutes Nierenversagen und sekundäre Wundinfektionen (Bae & Bourget, 2022).
- Die Sterblichkeit infolge der Infektion ist meist auf Atemversagen und kardiovaskulären Kollaps zurückzuführen, der mit einer autonomen Dysfunktion einhergeht (Robert Koch-Institut, 2018; Bae & Bourget, 2022).
Prävention
Neben der aktiven Immunisierung durch die vorhandenen Impfstoffe (s. Kapitel Tetanus: Die Impfung) gibt es weitere Maßnahmen in Akutsituationen (auch für Beteiligte), um das Risiko für einen schweren Verlauf zu verringern:
- Angemessene Wundversorgung (sowohl tief- als auch oberflächig), vor allem auch durch Notärzte (Richardson & Knight, 1993).
- Verhinderung einer Rekontamination durch Verbände und/oder Desinfektionsmittel (World Health Organization, 2013).
- Helfer sollten schützende und geschlossene Kleidung tragen (World Health Organization, 2013).
Tetanus kann nicht ausgerottet werden, da sowohl der Erreger selbst nicht ausgelöscht werden kann als auch die Antikörperspiegel gegen das Toxin nach einem gewissen Zeitraum nach der Impfung nachlassen.
Prognose
- Laut RKI liegt durch den Einsatz intensivmedizinischer Maßnahmen die Letalität zwischen 10 und 20 %, ansonsten wäre sie weitaus höher (Robert Koch-Institut, 2018).
- Die Mortalität steht im direkten Zusammenhang mit der Länge der Inkubationszeit. Wenn die Inkubationszeit weniger als oder genau 7 Tage beträgt, ist die Sterblichkeit signifikant höher. Ab 10 Tagen wird häufig ein milderer Verlauf beobachtet (Wassilak et al., 2008).
- Ebenso stehen Tachykardie und zunehmendes Alter bei Patienten in Verbindung mit höherer Mortalität (Saltoglu et al., 2004).
- Naturkatastrophen (Erdbeben, Tsunamis etc.) scheinen das Risiko für Tetanuserkrankungen in Industrieländern im Gegensatz zu Entwicklungsländern nicht zu erhöhen (Afshar et al., 2011; Centers for Disease Control and Prevention, 2022).
Risikofaktoren für einen schweren Verlauf bei der generalisierten Form sind
- Diabetes,
- Immunsuppression und
- intravenöser Drogenmissbrauch (Centers for Disease Control and Prevention, 2022).
Risikofaktoren für neonatalen Tetanus umfassen vor allem
- die septische Durchtrennung der Nabelschnur,
- Neugeborenen-Tetanus bei einem früheren Kind und
- infektiöse Substanzen, die im Rahmen kultureller oder religiöser Praktiken auf den Nabelstumpf aufgetragen werden, wie z. B. Tiermist, Schlamm, Ghee oder Ähnliches (Bennett et al., 1999; Bae & Bourget, 2022).
Therapie
- Es gibt so gut wie keine Belege für eine effektive therapeutische Intervention bei Tetanus. Diazepam wurde nie richtig evaluiert, zu Magnesiumsulfat gibt es nur Hinweise. Vorschläge, die von Vitaminen bis zu alpha- und beta-adrenergen Rezeptorblockern reichten, wurden nie ausreichend bewertet, sodass keine routinemäßigen Medikamente empfohlen werden können. Die Forscher Thwaites & Farrar folgerten, dass seit der Einführung des Penicillins in den 1940er Jahren keine größeren Fortschritte mehr bei der Behandlung erzielt wurden. Stattdessen sei die ganze Palette moderner Intensivmaßnahmen notwendig, um der Erkrankung zu begegnen (Thwaites & Farrar, 2003).
- Beim Vergleich zwischen humanem Tetanus-Immunglobulin und Tetanus-Antiserum sowie Penicillin und Metronidazol wurden ähnliche Ergebnisse in Bezug auf die Mortalität festgestellt (Saltoglu et al., 2004).
- Patienten sollten in einer ruhigen Umgebung gepflegt werden, um Spasmen durch Geräusche oder sensorische Stimulation zu vermeiden (Hassel, 2013).
- Die STIKO hat eine Empfehlung zur Immunprophylaxe im Verletzungsfall herausgegeben, die je nach Immunisierungsgrad und Art der Wunde zu Immunglobulinen und/oder einer Simultanimpfung rät:
Dokumentierter
Tetanus-Impfstatus
Zeit seit letzter
Impfung
TDaP/Tdap2
Tetanusimmunglobulin (TIG)3
Saubere geringfügige Wunden
Ungeimpft oder
unbekannt
Ja
Ja
1 oder 2 Impfstoffdosen
Ja4
Nein
≥ 3 Impfstoffdosen
≥ 10 Jahre
Ja
Nein
< 10 Jahre
Nein
Nein
Alle anderen
Wunden1
< 3 Impfstoffdosen oder unbekannt
Ja4
Ja
≥ 3 Impfstoffdosen
≥ 5 Jahre
Ja
Nein
Nein
Nein
1 Tiefe und/oder verschmutzte (mit Staub, Erde, Speichel, Stuhl kontaminierte) Wunden, Verletzungen mit Gewebszertrümmerung und reduzierter Sauerstoffversorgung oder Eindringen von Fremdkörpern (z. B. Quetsch-, Riss-, Biss-, Stich-, Schusswunden), schwere Verbrennungen und Erfrierungen, Gewebsnekrosen, septische Aborte.
2 Kinder unter 6 Jahren erhalten einen Kombinationsimpfstoff mit TDaP, ältere Kinder und Jugendliche Tdap. Erwachsene erhalten ebenfalls Tdap, wenn sie noch keine Pertussis-Impfung im Erwachsenenalter (≥ 18 Jahre) erhalten haben oder sofern eine aktuelle Indikation für eine Pertussis-Impfung besteht.
3 TIG = Tetanus-Immunglobulin. Im Allgemeinen werden 250 IE TIG verabreicht. TIG wird simultan mit dem TDaP- bzw. Tdap-Impfstoff kontralateral appliziert. Die TIG-Dosis kann auf 500 IE erhöht werden bei: (a) infizierten Wunden, bei denen eine angemessene chirurgische Behandlung nicht innerhalb von 24 h gewährleistet ist; (b) tiefen oder kontaminierten Wunden mit Gewebszertrümmerung und reduzierter Sauerstoffversorgung; (c) Eindringen von Fremdkörpern (z. B. Biss-, Stich- oder Schusswunden); (d) schweren Verbrennungen und Erfrierungen, Gewebsnekrosen und septischen Aborten.
4 Im Falle von Patienten, bei denen die Grundimmunisierung begonnen, aber noch nicht abgeschlossen ist (z. B. Säuglinge), muss der Abstand zur letzten Dosis berücksichtigt werden. Eine postexpositionelle Impfung am Tag der Wundversorgung ist nur sinnvoll, wenn der Abstand zu der vorhergehenden Impfstoffdosis mindestens 28 Tage beträgt. Bezüglich des Abschlusses einer Grundimmunisierung gelten im Übrigen die Nachholimpfempfehlungen der STIKOTabelle 1: Tetanus-Immunprophylaxe im Verletzungsfall entsprechend der aktuellen STIKO-Empfehlungen (Robert Koch-Institut, 2018).
- Die S1 Leitlinie zur Diagnostik und Behandlung von Tetanus empfiehlt die Gabe von humanem Tetanus-Immunglobulin (hTIG) und die aktive Immunisierung mit Tetanus-Toxoid (TTX-Td) unabhängig vom Impfstatus oder der Schwere der Infektion (Pfausler, 2017).
Epidemiologie
- Eine Tetanuserkrankung ist in Deutschland nicht meldepflichtig und wird daher nicht im Infektionsepidemiologischen Jahrbuch des RKI aufgeführt (Robert Koch-Institut, 2021).
- Aufgrund der besseren Lebensbedingungen gegenüber Entwicklungsländern werden in Deutschland jährlich weniger als 15 Erkrankungsfälle verzeichnet. Doch aufgrund der fehlenden Meldepflichtigkeit sind diese Daten nur eingeschränkt nutzbar (Robert Koch-Institut, 2018).
- Die höchste Inzidenz an Tetanus findet sich in Europa bei älteren Menschen, was sich dadurch erklären lässt, dass die Antikörperspiegel mit zunehmendem Alter abnehmen (European Centre for Disease Prevention and Control, 2010). Die Inzidenz der über 65-Jährigen lag 2018 bei 0,09 Fällen pro 100.000 Einwohner und machte 75 % aller Fälle aus. Bei zwei Drittel (ca. 68 %) aller Erkrankungen waren Frauen betroffen (European Centre for Disease Prevention and Control, 2020).
- Die weltweite Inzidenz ist aufgrund der fehlenden Meldepflicht in vielen Ländern oder der unvollständigen Meldung an die WHO unklar. Dementsprechend wurden im Jahr 2000 nur 18.833 Fälle an die WHO gemeldet – 67 Länder, davon viele Risikogebiete, meldeten gar keine Fälle (Thwaites & Farrar, 2003).
- Auf Basis von Umfragen wird vermutet, dass nur ca. 3 % des weltweit vorkommenden neonatalen Tetanus berichtet wird. Durch Daten der WHO und von Krankenhäusern in Vietnam schätzten Forscher die weltweite Inzidenz auf 700.000 bis 1.000.000 Fälle pro Jahr (Thwaites & Farrar, 2003).
- „In den Industrieländern stellt der Neugeborenentetanus eine Rarität dar (z. B. 4 Fälle von Neugeborenentetanus seit 1984 in den USA, kein Fall in Deutschland seit Jahrzehnten), seit in der Geburtshilfe die Nabelschnurdurchtrennung mit aseptischem Werkzeug durchgeführt wird und die große Mehrheit der Gebärenden einen ausreichenden Impfschutz gegen Tetanus aufweist. Somit können die Mütter ihren Neugeborenen maternale Antikörper gegen Tetanus mitgeben, und es kann von einem zuverlässigen Nestschutz gegen Tetanus ausgegangen werden. In den ersten Lebensmonaten ist das Verletzungsrisiko äußerst gering und eine Infektion mit Clostridium tetani äußerst selten.“ (Robert Koch-Institut, 2016).
- Das Institute for Health Metrics and Evaluation (IHME) schätzt auch nicht-gemeldete und unbestätigte Fälle von Tetanus-Erkrankungen. In den letzten Jahren haben sich diese Berechnungen immer weiter den bestätigten Fällen der WHO angenähert, obwohl diese von 1995 bis 2019 relativ konstant geblieben sind. Seit 2015 liegen die Schätzungen des IHME erstmals unter 100.000 Fällen pro Jahr, seit den Pandemie-Jahren (ab 2020) verzeichnet die WHO einen starken Rückgang an bestätigten Fällen.
Abbildung 2: WHO vs IHME weltweite Inzidenz an Tetanus (Behrens et al., 2019).
- Das RKI gibt an, dass 2006 weltweit ca. 290.000 Menschen an Tetanus gestorben sind, davon 250.000 an neonatalem Tetanus, der vor allem bei Neugeborenen in Entwicklungsländern auftritt (Robert Koch-Institut, 2018). Dies steht jedoch im Widerspruch zu der Schätzung des IHME, nach der die weltweite Fallzahl (!) für 2006 bei knapp unter 200.000 lag.
- Tetanus: Die Impfung
Die Impfung
- Die ersten Tetanusimpfstoffe wurden 1924 produziert und umfangreich im zweiten Weltkrieg zum Schutz der Soldaten eingesetzt. Darauf folgten ausgedehnte Impfprogramme (World Health Organization, 2017).
- Die Impfstoffe enthalten nicht das Bakterium Clostridium Tetani, sondern eine inaktivierte Form des von diesem Bakterium abgesonderten Toxins, das an ein Adjuvans gebunden ist.
- In Deutschland sind 17 Impfstoffe zugelassen, die eine Komponente zur Immunisierung gegen Tetanus enthalten. Es handelt sich bei allen um Kombinationsimpfstoffe, die mindestens auch einen Inhaltsstoff zur Immunisierung gegen Diphterie enthalten. Ein Einzelimpfstoff ist in Deutschland zurzeit nicht zugelassen bzw. beim Paul-Ehrlich-Institut gelistet (Paul-Ehrlich-Institut, 2023). Welche Impfstoffe zugelassen sind, wogegen sie immunisieren sollen und ab welchem Alter sie zugelassen sind, ist Tabelle 2 zu entnehmen.
Impfstoffname
Komponenten
Zugelassen ab (Alter)
Besonderheit
Boostrix
Diphtherie, Tetanus, Pertussis
4 Jahren
Auffrischimpfstoff
Boostrix Polio
Diphtherie, Tetanus, Pertussis, Polio
3 Jahren
Covaxis
Diphtherie, Tetanus, Pertussis
4 Jahren
Auffrischimpfstoff
Hexacima
Diphtherie, Tetanus, Pertussis, Polio, HiB, Hepatitis B
6 Wochen
Hexyon
Diphtherie, Tetanus, Pertussis, Polio, HiB, Hepatitis B
7 Wochen
Infanrix
Diphtherie, Tetanus, Pertussis
2 Monaten-6 Jahren
Infanrix hexa
Diphtherie, Tetanus, Pertussis, Polio, HiB, Hepatitis B
2 Monaten
Infanrix-IPV + HiB
Diphtherie, Tetanus, Pertussis, Polio, HiB
2 Monaten
Pentavac
Diphtherie, Tetanus, Pertussis, Polio, HiB
2 Monaten
Repevax
Diphtherie, Tetanus, Pertussis, Polio
3 Jahren
Auffrischimpfstoff
Revaxis
Diphtherie, Tetanus, Polio
5 Jahren
Auffrischimpfstoff
Td-Immun
Diphtherie, Tetanus
5 Jahren
Auffrischimpfung
Td-Impfstoff Merieux
Diphtherie, Tetanus
5 Jahren
Td-pur
Diphtherie, Tetanus
5 Jahren
Auffrischimpfstoff
TdaP-IMMUN
Diphtherie, Tetanus, Pertussis
4 Jahren
Auffrischimpfstoff
Tetravac
Diphtherie, Tetanus, Pertussis, Polio
2 Monaten
(derzeit nicht vermarktet)
Vaxelis
Diphtherie, Tetanus, Pertussis, Polio, HiB, Hepatitis B
6 Wochen
Tabelle 2: Zugelassene Impfstoffe, die eine Komponente gegen Tetanus enthalten, sowie die Altersempfehlung. Die Tabelle spiegelt nicht unbedingt die aktuelle Marktsituation wider (Paul-Ehrlich-Institut, 2023).
- Die STIKO empfiehlt Impfungen im Alter von 2, 4 und 11 Monaten zur Grundimmunisierung. Danach soll eine Auffrischimpfung ab 5 Jahren, eine ab 9 Jahren und danach alle 10 Jahre erfolgen (Robert Koch-Institut, 2023).
- In Deutschland sind etwa 53,9 % der Erwachsenen vollständig (inklusive Auffrischimpfung in den letzten 10 Jahren) geimpft (Robert-Koch-Institut, 2021).
- Für einen vollständigen Schutz empfiehlt die WHO 6 Impfungen. Drei davon im ersten halben Lebensjahr, beginnend im Alter von sechs Wochen, im Abstand von mindestens vier Wochen. Drei Auffrischungen sollten im Alter von 12-23 Monaten, vier bis sieben Jahren und neun bis 17 Jahren erfolgen, wobei immer vier Jahre zwischen den Auffrischimpfungen liegen sollten. Danach sind keine Impfungen mehr vorgesehen (World Health Organization, 2018).
Wirksamkeit
- Es gibt keinen Wirksamkeitsnachweis der Tetanus-Impfstoffe. Die vermutete Wirksamkeit erfolgt über die Erfassung von Antikörpertitern. Diese können für einen vermuteten Schutz aber je nach Test unterschiedlich hoch ausfallen. Außerdem sind Infektionen trotz ausreichend hoher Antikörpertiter aufgetreten (World Health Organization, 2017).
- Deshalb sollte Tetanus auch bei Geimpften nicht ausgeschlossen werden. Wie häufig Geimpfte an Tetanus erkranken und woran dies liegt, ist unklar (Hopkins et al., 2014).
- Wie im Abschnitt Epidemiologie (LINK) erwähnt, tritt Neugeborenen-Tetanus in Deutschland nicht auf. Allerdings ist es eines der von der WHO festgestellten „Public Health Problems“, vor allem in Entwicklungsländern in Afrika und Asien (World Health Organization, 2017). Die Studienlage zur Wirksamkeit der Tetanus-Impfungen als Schutz vor Neugeborenen-Tetanus ist ebenso nicht aussagekräftig. Die Metaanalysen, die höchstens ein oder zwei RCTs umfassen, zeigen jedoch einen Schutz (Blencowe et al., 2010; Demicheli et al., 2015).
Abbildung 3: Länder, in denen „Maternal Neonatal Tetanus“ (MNT) bis 2020 eliminiert (grün) bzw. nicht eliminiert (rot) war. MNT war im Jahr 2020 noch in 12 Ländern endemisch bzw. nicht eliminiert (Ochmann, 2018).
Nebenwirkungen
- Tetanus-haltige Impfstoffe: Guillian-Barré-Syndrom, Plexus-brachialis-Neuritis
- Hepatitis-B-haltige Impfstoffe: Periphere Neuropathie (Polyradikuloneuritis, Fazialisparese), Optikusneuritis, Demyelinisierung des Zentralnervensystems (Multiple Sklerose)
- Haemophilus-influenzae-Typ-b-haltige Impfstoffe: ödematöse Reaktionen an einer der beiden unteren Gliedmaßen nach Grundimmunisierung. Begleitsymptome: Zyanose, Rötung transiente Purpura, heftiges Schreien
Häufigkeit
Reaktion
Sehr häufig (≥ 1/10)
Reaktionen an der Injektionsstelle (wie Rötung und/oder Schwellung), Schmerzen an der Injektionsstelle, Müdigkeit, Unwohlsein, Abgeschlagenheit, Krankheitsgefühl, Schüttelfrost, Schmerz, Erythem, Rötung und/oder Schwellung an der Injektionsstelle, Appetitlosigkeit/Appetitverlust, Reizbarkeit/Nervosität, Schläfrigkeit, Kopfschmerzen, ungewöhnliches Schreien, Somnolenz/Benommenheit, Erbrechen, Übelkeit, Durchfall, generalisierter Muskelschmerz oder Muskelschwäche, Arthralgie oder Gelenkschwellung, Fieber (> 38°C)
Häufig (≥ 1/100 bis < 1/10)
Lymphadenopathie, Unruhe, Schwindel, gastrointestinale Beschwerden, Ausschlag, Pruritus, Fieber > 39 °C, ausgedehnte Schwellung der Extremität, an der die Impfung vorgenommen wurde (manchmal unter Einbeziehung des angrenzenden Gelenks), Reaktionen an der Injektionsstelle (wie Blutung, Pruritus und Verhärtung, Wärme, Taubheit, steriler Abszess, Dermatitis, Juckreiz), Induration an der Einstichstelle, Schlaflosigkeit (Schlafstörung)
Gelegentlich (≥ 1/1.000 bis < 1/100)
Infektion der oberen Atemwege, Pharyngitis, Herpes labialis, Apathie, Aufmerksamkeitsstörung, Synkope, Parästhesie, Konjunktivitis, Husten, Trockener Rachen, Asthma, Bronchitis, Bauchschmerzen, Hyperhidrose, Urtikaria, Myalgie, Gelenksteife, Steifheit der Skelettmuskulatur, grippeähnliche Beschwerden, Knötchen an der Einstichstelle, Überempfindlichkeitsreaktion, Schnupfen, verstärkter Appetit
Selten (≥ 1/10.000 bis < 1/1.000)
Krampfanfälle mit oder ohne Fieber, starke Schwellung der betroffenen Extremität, Allergische Reaktion (anaphylaktische/anaphylaktoide Reaktion), Bläschen an der Injektionsstelle
Sehr selten
(< 1/10.000)
aufsteigende Lähmung, Atemlähmung, Guillian-Barré-Syndrom (meist bei Tetanustoxoid-haltigen Impfstoffen), Muskelhypotonie oder hypoton-hyporesponsive Epsioden (HHE) (Kollaps/schockähnlicher Zustand), Ohnmacht, allergische Erkrankung der Niere, verbunden mit vorübergehender Proteinurie
Ohne Angabe der Häufigkeit
Thrombozytopenie (bei Tetanus- und Diphtheriehaltigen Impfstoffen), Plexus-brachialis-Neuritis (meist bei Tetanustoxoid-haltigen Impfstoffen), Gesichtslähmung, Synkope, Myelitis, Apnoe (Frühgeborene vor 28. SSW), Angioödem, Myositis, Asthenie, Angioödem, Ödem, Hypotonie, Myokarditis, Enzephalopathie, Enzephalitis, Gesichtsödem, Schock, Bronchospasmus, Blässe, vorübergehende Parästhesie und Hypästhesie des Arms, in den der Impfstoff verabreicht wurde
Tabelle 3: Impfreaktionen und -nebenwirkungen der 17 zugelassenen Impfstoffe, die eine Tetanus-Komponente enthalten. Aus Gründen der Übersichtlichkeit wurde auf eine Differenzierung zwischen Kindern und Erwachsenen verzichtet. Außerdem können vereinzelt für einige Impfstoffe Komplikationen seltener ausfallen als angegeben. Die Informationen stammen aus den Fachinformationen der jeweiligen Impfstoffe.
(Robert Koch-Institut, 2016)
- Tetanus: Die STIKO-Empfehlungen
Die Empfehlungen
- Die STIKO empfiehlt, Neugeborenen 3 Impfstoffdosen im Alter von 2, 4 und 11 Monaten mit einem Kombinationsimpfstoff gegen Tetanus, Diphtherie, Keuchhusten, Kinderlähmung, Hib und Hepatitis B zu verabreichen.
- Frühgeborene (Geburt vor der 37. SSW) sollen 4 Impfstoffdosen im Alter von 2, 3, 4 und 11 Monate erhalten.
- Zwischen der vorletzten und letzten Impfung soll ein Zeitraum von mindesten 6 Monaten liegen.
- Auffrischungsimpfungen werden im Alter von 5 bis 6 Jahren, 9 bis 16 Jahren und dann folgend mit 10-jährigem Abstand empfohlen.
- Erwachsene mit unklarem oder unvollständigem Impfschutz sollen eine Erstimmunisierung erhalten.
- Nach dem Motto der STIKO „Jede Impfung zählt!“ gibt es grundsätzlich keine unzulässig großen Abstände zwischen den Impfungen, d. h. eine unvollständige Grundimmunisierung könne auch nach Jahren noch fortgesetzt werden. Wichtiger sei, dass der Mindestabstand zwischen den Impfungen eingehalten werde.
Eine Übersicht zu den oben genannten Impfungen bietet der Impfkalender der STIKO.
(Robert Koch-Institut, 2023)
Kritik an den STIKO-Empfehlungen
- In Deutschland ist eine Auffrischimpfung im Erwachsenenalter alle 10 Jahre empfohlen. Dies widerspricht allerdings sowohl der Empfehlung der WHO, die höchstens eine Auffrischung nach 30 Jahren empfiehlt, als auch mehreren Studien, die zu dem Ergebnis kommen, dass nach einer Grundimmunisierung im Kindesalter Auffrischungen im Erwachsenenalter keinen Nutzen haben (Hammarlund et al., 2016; Slifka et al., 2021).
- Literaturverzeichnis
Afshar, M., Raju, M., Ansell, D., & Bleck, T. P. (2011). Narrative review: Tetanus-a health threat after natural disasters in developing countries. Annals of Internal Medicine, 154(5), 329–335. https://doi.org/10.7326/0003-4819-154-5-201103010-00007
Bae, C., & Bourget, D. (2022). Tetanus. In StatPearls. StatPearls Publishing. http://www.ncbi.nlm.nih.gov/books/NBK459217/
Behrens, H., Ochmann, S., Dadonaite, B., & Roser, M. (2019). Tetanus. Our World in Data. https://ourworldindata.org/tetanus
Bennett, J., Ma, C., Traverso, H., Agha, S. B., & Boring, J. (1999). Neonatal tetanus associated with topical umbilical ghee: Covert role of cow dung. International Journal of Epidemiology, 28(6), 1172–1175. https://doi.org/10.1093/ije/28.6.1172
Blencowe, H., Lawn, J., Vandelaer, J., Roper, M., & Cousens, S. (2010). Tetanus toxoid immunization to reduce mortality from neonatal tetanus. International Journal of Epidemiology, 39(Suppl 1), i102–i109. https://doi.org/10.1093/ije/dyq027
Centers for Disease Control and Prevention. (2022, August 29). For Clinicians. Tetanus. https://www.cdc.gov/tetanus/clinicians.html
Demicheli, V., Barale, A., & Rivetti, A. (2015). Vaccines for women for preventing neonatal tetanus. The Cochrane Database of Systematic Reviews, 2015(7), CD002959. https://doi.org/10.1002/14651858.CD002959.pub4
European Centre for Disease Prevention and Control. (2010, Juli 29). Disease factsheet about tetanus. Ecdc. https://www.ecdc.europa.eu/en/tetanus/facts
European Centre for Disease Prevention and Control. (2020, Dezember 3). Tetanus—Annual Epidemiological Report for 2018. https://www.ecdc.europa.eu/en/publications-data/tetanus-annual-epidemiological-report-2018
Farrar, J. J., Yen, L. M., Cook, T., Fairweather, N., Binh, N., Parry, J., & Parry, C. M. (2000). Tetanus. Journal of Neurology, Neurosurgery & Psychiatry, 69(3), 292–301. https://doi.org/10.1136/jnnp.69.3.292
George, E. K., De Jesus, O., & Vivekanandan, R. (2023). Clostridium Tetani. In StatPearls. StatPearls Publishing. http://www.ncbi.nlm.nih.gov/books/NBK482484/
Hammarlund, E., Thomas, A., Poore, E. A., Amanna, I. J., Rynko, A. E., Mori, M., Chen, Z., & Slifka, M. K. (2016). Durability of Vaccine-Induced Immunity Against Tetanus and Diphtheria Toxins: A Cross-sectional Analysis. Clinical Infectious Diseases, 62(9), 1111–1118. https://doi.org/10.1093/cid/ciw066
Hassel, B. (2013). Tetanus: Pathophysiology, treatment, and the possibility of using botulinum toxin against tetanus-induced rigidity and spasms. Toxins, 5(1), 73–83. https://doi.org/10.3390/toxins5010073
Hopkins, J., Riddle, C., Hollidge, M., & Wilson, S. (2014). A systematic review of tetanus in individuals with previous tetanus toxoid immunization. Canada Communicable Disease Report, 40(17), 355–364. https://doi.org/10.14745/ccdr.v40i17a03
Leshem, Y., & Herman, J. (1989). Tetanus immunity in kibbutz women. Israel Journal of Medical Sciences, 25(3), 127–130.
Matzkin, H., & Regev, S. (1985). Naturally acquired immunity to tetanus toxin in an isolated community. Infection and Immunity, 48(1), 267–268. https://doi.org/10.1128/iai.48.1.267-268.1985
Ochmann, S. (2018, Februar 16). Year of maternal neonatal tetanus elimination. Our World in Data. https://ourworldindata.org/grapher/year-of-maternal-neonatal-tetanus-mnt-elimination
Paul-Ehrlich-Institut. (2023, Mai 23). Tetanus-Impfstoffe (Wundstarrkrampf). Arzneimittel – Impfstoffe. https://www.pei.de/DE/arzneimittel/impfstoffe/tetanus-wundstarrkrampf/tetanus-node.html?cms_gtp=174562_list%253D2&cms_tabcounter=0#anchor
Pfausler, B. (2017). Tetanus (Entwicklungsstufe: S1; Leitlinien für Diagnostik und Therapie in der Neurologie). Kommission Leitlinien der Deutschen Gesellschaft für Neurologie. https://register.awmf.org/assets/guidelines/030-104l_S1_Tetanus_2017-11-abgelaufen.pdf
Richardson, J. P., & Knight, A. L. (1993). The management and prevention of tetanus. The Journal of Emergency Medicine, 11(6), 737–742. https://doi.org/10.1016/0736-4679(93)90634-j
Robert Koch-Institut. (2016, Juli 4). Schutzimpfung gegen Tetanus: Häufig gestellte Fragen und Antworten. Impfungen A - Z. https://www.rki.de/SharedDocs/FAQ/Impfen/Tetanus/FAQ-Liste_Tetanus_Impfen.html
Robert Koch-Institut. (2018, November 27). Tetanus. RKI-Ratgeber. https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Tetanus.html
Robert Koch-Institut. (2021, September 20). Infektionsepidemiologisches Jahrbuch (Archiv). RKI. https://www.rki.de/DE/Content/Infekt/Jahrbuch/jahrbuch_node.html
Robert-Koch-Institut, R. (2021). Impfquoten bei Erwachsenen | COVID-19 Impfdurchbrüche in Münchner Pflegeeinreichtungen. Epidemiologisches Bulletin 50/2021. https://www.rki.de/DE/Content/Infekt/EpidBull/Archiv/2021/Ausgaben/50_21.pdf?__blob=publicationFile
Robert Koch-Institut. (2023). Empfehlungen der Ständigen Impfkommission beim Robert Koch-Institut 2023. Epidemiologisches Bulletin, 4. https://doi.org/10.25646/10829
Saltoglu, N., Tasova, Y., Midikli, D., Burgut, R., & Dündar, I. H. (2004). Prognostic factors affecting deaths from adult tetanus. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases, 10(3), 229–233. https://doi.org/10.1111/j.1198-743x.2004.00767.x
Slifka, A. M., Park, B., Gao, L., & Slifka, M. K. (2021). Incidence of Tetanus and Diphtheria in Relation to Adult Vaccination Schedules. Clinical Infectious Diseases, 72(2), 285–292. https://doi.org/10.1093/cid/ciaa017
Thwaites, C. L., & Farrar, J. J. (2003). Preventing and treating tetanus. BMJ : British Medical Journal, 326(7381), 117–118.
Veronesi, R., Cecin, H., Corrêa, A., Tavares, J., Moraes, C., & Bertoldo, O. J. (1975). New concepts on tetanus immunization: Naturally acquired immunity. Journal of Hygiene, Epidemiology, Microbiology, and Immunology, 19(1), 126–134.
Wassilak, W., Roper, M., Kretsinger, K., & Orenstein, S. (2008). Tetanus Toxoid. In: Plotkin S, Orenstein WA, Offit PA, editors. Elsevier Saunders, 2008: 805-839. Elsevier Saunders.
World Health Organization. (2013, November 20). Tetanus: Immunization. Questions & Answers. https://www.who.int/news-room/questions-and-answers/item/tetanus-immunization
World Health Organization. (2017, Februar 10). Tetanus vaccines. WHO Position Paper – February 2017. https://www.who.int/publications-detail-redirect/WHO-WER9206
World Health Organization. (2018, Mai 9). Tetanus. Fact Sheets. https://www.who.int/news-room/fact-sheets/detail/tetanus
Stand: 1. Juni 2023
Nächste Aktualisierung: 1. Juni 2024

