Kostenlos: der ÄFI-Newsletter
Bleiben Sie auf dem Laufenden beim Thema
Impfungen & Impfentscheidung und rund um den Verein.
Keuchhusten (Pertussis)
Um was für einen Erreger handelt es sich bei Keuchhusten? Auf welchem Weg erfolgt eine Übertragung? Wie häufig sind asymptomatische und atypische Fälle? Welche Bevölkerungsgruppen haben das höchste Risiko für einen schweren Verlauf? Hilft die Impfung dabei, Keuchhusten-Fälle zu reduzieren? Und wie evidenzbasiert ist die aktuelle STIKO-Empfehlung?
Antworten auf diese und weitere Fragen finden Sie im nachfolgenden Fachbeitrag.
Vorbemerkung
Die folgenden Ausführungen dienen der Information und ersetzen keinesfalls das ärztliche Beratungsgespräch. Hier werden Fakten präsentiert, die Eltern wie auch Ärztinnen und Ärzten in einem Aufklärungsgespräch helfen können. Ärztinnen und Ärzte für individuelle Impfentscheidung e. V. (ÄFI) übernimmt keine Garantie für Vollständigkeit, hat die hier verfügbaren Inhalte jedoch nach bestem Wissen und Gewissen am aktuellen Fach- und Sachstand zusammengetragen. Über die wissenschaftliche Arbeit des Vereins erfahren Sie hier mehr. Der Fachbeitrag wird jährlich aktualisiert. Das dargelegte Wissen entspricht dem Kenntnisstand zum angegebenen Veröffentlichungs- bzw. Aktualisierungsdatum. Weitere Informationen erhalten Sie auch in unserem Podcast.
Im Podcast anhören
Fachbeitrag
- Keuchhusten: Die Erkrankung
Erreger
- Bordetella pertussis (B. pertussis) ist ein Bakterium, genauer gesagt ein unbewegliches, bekapseltes, aerobes gramnegatives Stäbchen der Gattung Bordetella und der Familie Alcaligenaceae.
- Als primärer (aber nicht entscheidender) Virulenzfaktor wird inzwischen das Pertussis Toxin (PT) verstanden, das vor der exakten Identifikation auch als Lymphozytose-fördernder Faktor (LPF), Insel-aktivierendes Protein (IAP) und Histamin-sensibilisierender Faktor (HSF) bezeichnet wurde (Locht & Antoine, 2021).
- Weitere Toxine und Virulenzfaktoren sind filamentöses Hämagglutinin (FHA), Trachea-Zytotoxin, Pertactin, hitzelabiles Toxin und Adenylatzyklase-Hämolysin (Robert Koch-Institut, 2022).
- Als Hauptbestandteil der Membran dienen Lipopolysaccharide, die auch bei anderen gramnegativen Bakterien vorkommen (Freudenberg, 2004).
- Neben B. pertussis können selten auch B. parapertussis, B. bronchiseptica oder B. holmesii zu einem ähnlichen, aber vor allem leichteren und kürzeren Krankheitsbild führen (Robert Koch-Institut, 2022). B. pertussis macht etwa 86 bis 95 % aller Keuchhusten-Fälle aus (Nieves & Heininger, 2016). Der Anteil von B. parapertussis ist von 3-4 % (2015-2018) auf 9 % (2019) gestiegen (Robert Koch-Institut, 2022).
- Der Mensch stellt das einzige bekannte Reservoir für B. pertussis dar (Kilgore et al., 2016).
 Abbildung 1: Dreidimensionale, computergenerierte Darstellung von einer Gruppe B.-pertussis-Bakterien, basierend auf rasterelektronenmikroskopischen (SEM) Bildern (Cutchin & Newlove, 2016).
Abbildung 1: Dreidimensionale, computergenerierte Darstellung von einer Gruppe B.-pertussis-Bakterien, basierend auf rasterelektronenmikroskopischen (SEM) Bildern (Cutchin & Newlove, 2016).
Infektionsmodus
- Die Inkubationszeit beträgt in der Regel 7 bis 10 Tage, kann aber auch bis zu drei Wochen betragen (Kilgore et al., 2016; Centers for Disease Control and Prevention, 2022a).
- Infizierte Personen sind nach der Inkubationszeit, ab dem Stadium catarrhale, infektiös – innerhalb von drei Wochen nach Symptombeginn ist das Risiko für die Transmission am höchsten (Nieves & Heininger, 2016; Centers for Disease Control and Prevention, 2022a).
- Ob Stillen einen Schutz für Säuglinge vor der Keuchhusten-Erkrankung bietet, wenn die stillenden Mütter nicht zuvor in der Schwangerschaft geimpft wurden, ist nicht endgültig geklärt. Es gibt jedoch einige Hinweise darauf, dass auch nicht-geimpfte Mütter ihren Säuglingen durch das Stillen einen gewissen Schutz vermitteln (Curtis et al., 2017; Pandolfi et al., 2017; Nascimento et al., 2021).
Asymptomatische Fälle
- Ein neueres systematisches Review nach PRISMA-Standard, in dem 26 Studien zur laborbestätigten Übertragung und Häufigkeit asymptomatischer Fälle von B. pertussis in Haushalten überprüft wurden, kam zu dem Ergebnis, dass bis zu 46,2 % aller Haushaltskontakte leichte/atypische Pertussis aufwiesen und 55,6 % aller Fälle asymptomatisch waren. Da jedoch in nur fünf Studien jeder Haushaltskontakt getestet wurde, sei eher eine Untererfassung milder/atypischer und asymptomatischer Fälle wahrscheinlich. Die Studienautoren folgerten, dass die Ergebnisse eine „Lücke in unserem Verständnis der Pertussis-Übertragung“ aufzeigen. Der Nachweis einer asymptomatischen Pertussis-Infektion sei schwer zu erbringen, in Beobachtungsstudien würden häufig nur typische Keuchhusten-Fälle aufgrund traditioneller Falldefinitionen identifiziert. Deshalb wurde lange Zeit von einer geringen Prävalenz asymptomatischer Fälle ausgegangen (Craig et al., 2020).
- Zu einem solchen Ergebnis kommt auch eine afrikanische Längsschnittstudie: Asymptomatische oder minimal-symptomatische Pertussis-Infektionen sind bei Erwachsenen „häufig verbreitet“ (common). Aufgrund des Mangels an Längsschnittdaten sei die Prävalenz asymptomatischer Fälle lange Zeit Gegenstand kontroverser Debatten in der Wissenschaft gewesen. Mittlerweile seien jedoch genügend Daten vorhanden, um diese These zu untermauern (Gill et al., 2021).
- Auch bei Schulkindern lässt sich anhand des Nachweises durch pooled real-time PCR-Tests eine „häufige Verbreitung“ feststellen (Zhang et al., 2020).
Übertragung
- B. pertussis ist hochkontagiös, die secondary attack rate (SAR) schwankt in Haushaltskontaktstudien zwischen 58 und 100 %. Außerhalb des Haushalts, zum Beispiel in Klassenraumkontaktstudien, ist die SAR mit 0 bis 36 % sehr viel niedriger (Warfel et al., 2012).
- Erstmals wurde 1916 die Hypothese aufgestellt, dass B. pertussis per Tröpfchen übertragen werden könnte. Fast 100 Jahre später, im Jahr 2012, wurde dann durch eine gut kontrollierte Pavian-Studie schließlich der Beweis erbracht, indem die Übertragung per Schmierinfektion ausgeschlossen werden konnte. Die Ergebnisse zeigten, dass 100 % der exponierten, naiven Tiere ohne Körperkontakt von anderen Tieren mit B. pertussis infiziert wurden (Warfel et al., 2012; Trainor et al., 2015).
- Eine symptomatische Erkrankung scheint für eine Übertragung dabei nicht erforderlich zu sein. Studien an Menschen und Pavianen deuten darauf hin, dass längerer enger, wiederholter Kontakt (z. B. im Haushalt) für eine Übertragung ausreichend ist. Das Risiko für eine Übertragung ist jedoch höher, wenn infizierte Individuen Husten aufweisen (Trainor et al., 2015).
Infektionsverlauf
Die typische Erstinfektion bei nicht-geimpften Personen verläuft in drei Stadien:
- Das Stadium catarrhale, mit einer Dauer von 1 bis 2 Wochen, verläuft ähnlich wie eine Infektion der oberen Atemwege bzw. eine Erkältung. Mögliche Symptome sind meist kein oder nur mäßiges Fieber, Müdigkeit und Rhinorrhoe. Stärkeres Fieber kann auf eine bakterielle Koinfektion hinweisen.
- Das Stadium convulsivum, welches etwa 4 bis 6 Wochen andauert, ist durch das Auftreten von für B. pertussis typische, anfallsweise auftretende Hustenstöße („Stakkatohusten“) charakterisiert, die von kräftigem Einatmen – hörbar als Keuchen/Juchzen („whoop“) – begleitet werden. Das Fieber ist zu diesem Zeitpunkt bereits abgeklungen. Durch die Hustenanfälle kann es zu Hervorwürgen von zähem Schleim sowie anschließendem Erbrechen kommen. Weiterhin können Zyanosen, Diaphoresen oder Apnoen auftreten.
- Im letzten Stadium decrementi, das etwa 6 bis 10 Wochen dauert, kommt es zur Rekonvaleszenz – die Hustenanfälle klingen allmählich wieder ab.
(Nieves & Heininger, 2016; Robert Koch-Institut, 2022; Lauria & Zabbo, 2023)
Abbildung 2: Typischer Krankheitsverlauf bei einer B. pertussis Infektion, eigene Darstellung.
Nicht selten kommt es zu untypischen Infektionen mit B. pertussis:
- Bei Jugendlichen und Erwachsenen, aber auch vielen geimpften Kindern verläuft die Erkrankung eher als lang anhaltender (nicht-anfallsartiger) Husten (Robert Koch-Institut, 2022).
- Dadurch wird die B.-pertussis-Infektion bei der Differentialdiagnose häufig übersehen (Centers for Disease Control and Prevention, 2022a).
Komplikationen
Pneumonie
- Die häufigste Komplikation und zugleich häufigste Todesursache nach einer Infektion mit B. pertussis ist eine sekundäre, bakterielle Lungenentzündung (z. B. verursacht durch Pneumokokken, Streptokokken oder Haemophilus influenzae) (Lauria & Zabbo, 2023).
- Das RKI gibt an, dass bis zu 10 % der Säuglinge und älteren Menschen von Pneumonien betroffen sind. Bei älteren Kindern, Jugendlichen und Erwachsenen kommt dies seltener vor (Robert Koch-Institut, 2022).
- Die CDC kommen durch Meldedaten aus den Jahren 2000 bis 2017 hingegen auf eine Prävalenz von durchschnittlich 13,2 % für alle Altersgruppen und 18,6 % für Säuglinge, die jünger sind als 6 Monate (Centers for Disease Control and Prevention, 2022b).
- In einer groß angelegten, sieben afrikanische und asiatische Länder (Low- and Middle-Income Countries, LMIC) umfassenden epidemiologischen Studie (PERCH) wurde die Fallsterblichkeit für Kinder mit Pertussis assoziierter Pneumonie im Alter zwischen 1 und 5 Monaten mit 12,5 % berechnet (Barger-Kamate et al., 2016).
Weitere Komplikationen
- Durch das Pertussis Toxin (PT) bedingt, wird eine erhöhte Anzahl zirkulierender weißer Blutkörperchen (Leukozytose) bei Patienten – und stark ausgeprägt vor allem bei jungen Kindern – festgestellt. Bei ungeimpften Individuen wird eine Häufigkeit von 72 % (im Gegensatz zu 38 % bei geimpften Individuen) erhöhter Leukozytenwerte erfasst. Die Leukozytose korreliert mit einem schwereren Verlauf, sodass moderne Behandlungen vor allem auf eine Verringerung der Leukozytenzahl abzielen. Der Zeitpunkt der Diagnose ist daher für die Prognose von Säuglingen von klinischer Relevanz (Carbonetti, 2016).
- In weniger als 2 % der Fälle kann es zu Komplikationen des zentralen Nervensystems (ZNS) kommen, wie z. B. Krampfanfälle und Enzephalopathie. Neuologische Komplikationen sind bei Säuglingen häufiger (Centers for Disease Control and Prevention, 2022b; Lauria & Zabbo, 2023).
- Weniger schwere Komplikationen umfassen Otitis media, Anorexie und Dehydrierung. Durch die Druckwirkung des anfallartigen Hustens kann es zudem zu Pneumothorax, Epistaxis, subdurale Hämatome, Hernien und Rektumprolaps kommen (Centers for Disease Control and Prevention, 2022b).
Folgen
- Ein systematisches Review zur Entwicklung langfristiger Folgeerscheinungen kommt zu dem Ergebnis, dass eine Keuchhusten-Erkrankung die Entwicklung bestimmter chronischer Erkrankungen (und damit entstehenden Hospitalisierungen) begünstigen kann – darunter z. B. Asthma. Die begutachteten Studien waren in ihren Ergebnissen uneinheitlich und zeigten teilweise auch keinen Zusammenhang. Für einige hämatologische Krebsformen sowie chronische Bronchitis konnte sogar ein verringertes Risiko festgestellt werden. Die Autoren schließen mit dem Fazit, dass weitere Forschungsarbeiten notwendig seien, um diese Zusammenhänge zu bestätigen oder zu widerlegen (Macina & Evans, 2021).
Pathogenese
- B. pertussis verbreitet sich (mit Ausnahme bei stark immungeschwächten Patienten) nur in den Atemwegen und nutzt dort vorzugsweise das Flimmerepithel zur Besiedlung (Parton, 1999).
- Neben dem Pertussis Toxin (PT) sind die Adhäsine von B. pertussis von Bedeutung, da sie dem Erreger ermöglichen, an den biologischen Strukturen des Wirts anzuheften (Hewlett et al., 2014).
- Auch wenn PT selbst in der Regel nicht zum Zelltod führt, stört es maßgeblich die Physiologie verschiedener Zelltypen durch die Unterbrechung der Regulierung der cAMP-Produktion. Weiterhin stört PT auch den Kalium- und Kalziumeinstrom in die Zellen, den cGMP-Spiegel und die Phototransduktion. Viele Auswirkungen der Pertussis-Infektion für den Menschen lassen sich so erklären, z. B. pulmonale Hypertonie, Lungenödem oder Hyperinsulinämie. Eine Verbindung zum anfallsartigen Husten lässt sich bisher nur indirekt herstellen. Wahrscheinlich wird in den nächsten Jahren nach mehr über PT in Erfahrung gebracht (Locht & Antoine, 2021).
Prävention
- Die Eradikation von B. pertussis ist laut RKI aus heutiger Sicht nicht möglich.
- Sowohl Impfungen wie auch Infektionen bieten eine zeitlich nur sehr begrenzte Immunität, wodurch die Ziele der Impfstrategie in Deutschland vor allem im Schutz gefährdeter Säuglinge und Kinder liegt.
- Erkrankte Personen bzw. Personen, die potentiell erkrankt sein könnten, dürfen nach § 34 IfSG in Gemeinschaftseinrichtungen keine Lehr-, Erziehungs-, Pflege-, Aufsichts- oder sonstigen Tätigkeiten ausüben, bei denen sie Kontakt zu den dort Betreuten haben. Als potentiell erkrankt gelten Personen mit Husten, die Kontakt zu Personen mit einer bestätigten Keuchhusten-Erkrankung während der infektiösen Phase hatten. Sollte dies bei Betreuten der Fall sein, so dürfen auch diese die Räumlichkeiten der Gemeinschaftseinrichtungen nicht betreten und auch nicht an Veranstaltungen teilnehmen.
- Eine Wiederzulassung erfolgt fünf Tage nach Beginn einer wirksamen Antibiotikatherapie oder, wenn keine Antibiotika verabreicht wurden, 21 Tage nach Beginn des Hustens. Für Krankheitsverdächtige kann ein negativer labordiagnostischer Befund für die Zulassung ausreichen, ansonsten ist auch hier der Zeitraum von 21 Tagen abzuwarten.
- Ein Ausschluss ist bei Personen in Gemeinschaftseinrichtungen nur erforderlich, wenn Husten als Symptom auftritt. Wenn Husten auftritt, sollen umgehend diagnostische Untersuchungen durchgeführt werden.
- Für ungeimpfte enge Kontaktpersonen wird eine Chemoprophylaxe mit Makroliden empfohlen, sofern ein Nachweis für eine B.-pertussis-Infektion vorliegt. Ähnliches gilt auch für geimpfte Infizierte, wenn sich Risikogruppen in der Umgebung befinden (z. B. ungeimpfte oder nicht vollständig geimpfte Säuglinge oder Kinder mit Grundleiden).
(Robert Koch-Institut, 2022)
Prognose
Als allgemeine Risikofaktoren für eine Infektion gelten:
- Schwangerschaft
- Epidemische Exposition
- Fehlende Immunisierung
- Enger Kontakt mit infizierten Personen
(Lauria & Zabbo, 2023)
- Für die allermeisten Menschen ist eine Keuchhusten-Infektion nicht lebensgefährlich und die Rekonvaleszenz setzt nach einer Krankheitsdauer von bis zu mehreren Monaten vollständig ein.
- Die Fallsterblichkeiten variieren teils erheblich, je nachdem aus welchen Ländern die Daten stammen und welche Altersgruppen eingeschlossen werden. Meist wird eine Gesamtsterblichkeit (overall case-fatality-rate) von 0-1 % ermittelt (Macina & Evans, 2021).
- Vor allem Säuglinge, aber auch ältere Menschen (mit Komorbiditäten) weisen die höchste Mortalitätsrate auf (Macina & Evans, 2021). Die Fallsterblichkeit bei Säuglingen wird mit ca. 1-3 % angegeben (Nieves & Heininger, 2016). Bei älteren Menschen kommt es vor allem aufgrund bestehender chronischer Erkrankung zu einer erhöhten Morbidität und Mortalität (Lauria & Zabbo, 2023).
Als Risikofaktoren für einen schweren Verlauf bei Kindern im Krankenhaus konnte in einer groß angelegten australischen Multicenter-Studie
- Alter unter 2 Monaten,
- Fieber über 37,5 Grad Celsius,
- Frühgeburtlichkeit und
- Koinfektionen
festgestellt werden. Die meisten schweren Keuchhustenfälle traten zwar bei jungen, nicht-geimpften Säuglingen auf, aber schwere Erkrankungen wurden auch bei geimpften Kindern im Alter von > 12 Monaten beobachtet (Marshall et al., 2015).
Therapie
- Eine antibiotische Therapie sollte möglichst früh erfolgen, um die Intensität des Hustens zu beeinflussen (vor Beginn oder in den ersten beiden Wochen nach Auftreten des Hustens).
- Antibiotika können für die Unterbrechung von Infektionsketten entscheidend sein, dann jedoch ausschließlich vor oder während der infektiösen Phase.
- Am häufigsten kommt das Makrolid Erythromycin zum Einsatz, aber auch Azithromycin und Clarithromycin sind wirksam. Alternativ zu diesen Makroliden kann auch Cotrimoxazol eingesetzt werden.
- Makrolid-Resistenzen wurden bisher selten beobachtet.
- Weiterhin sind eine ausreichende Flüssigkeitszufuhr sowie bei ausgeprägten Hustenanfällen kleinere Mahlzeiten sinnvoll. Es gibt wenig Evidenz für weitere unterstützende Maßnahmen.
(Robert Koch-Institut, 2022)
Alter
Therapie der Wahl
Alternativ
Azithromycin
Erythromycin-Estolat
Clarithromycin
TMP-SMX*
< 1 Monat
10 mg/kg KG/d in 1 Dosis für 5 Tage
40 mg/kg KG/d in 2 Dosen für 14 Tage
Cave: hypertrophe Pylorusstenose (selten)
nicht empfohlen
kontraindiziert unter 2 Monaten
1-6 Monate
10 mg/kg KG/d in 1 Dosis für 5 Tage
15 mg/kg KG/d in 2 Dosen für 7 Tage
kontraindiziert unter 2 Monaten
für Kinder im Alter > 2 Monate: TMP: 8 mg/kg KG/d, SMX 40 mg/kg KG/d in 2 Dosen für 14 Tage
> 6 Monate, Kleinkinder, Kinder
10 mg/kg KG in 1 Dosis am Tag 1; 5 mg/kg KG/d an Tagen 2-5 (max.: 500 mg)
40 mg/kg KG/d (max.: 2 g/d) in 2 Dosen für 14 Tage
15 mg/kg KG/d in 2 Dosen für 7 Tage (max.: 1 g/d)
TMP: 8 mg/kg KG/d, SMX 40 mg/kg KG/d in 2 Dosen für 14 Tage
Erwachsene
500 mg in 1 Dosis am Tag 1; 250 mg an Tagen 2-5
2 g/d in 2 Dosen für 14 Tage
1 g/d in 2 Dosen für 7 Tage
TMP: 320 mg/d, SMX 1600 mg/d in 2 Dosen für 14 Tage
Tabelle 1: Angaben zu Dosierungen und Therapiedauer der empfohlenen Antibiotika nach DGPI und Riffelmann et al. (2008) (Robert Koch-Institut, 2022). Die Angaben stellen keine Empfehlung zur Anwendung durch ÄFI dar, sondern geben nur den aktuellen Stand der Therapieoptionen wieder.
Epidemiologie
- Laut OurWorldinData mit Daten des Institute for Health Metrics and Evaluation (IHME) ist die Zahl der Todesfälle durch Keuchhusten von 256.637 im Jahr 1990 auf 116.510 im Jahr 2019 gesunken. Der Anteil von unter 5-jährigen betrug dabei stets ca. 92 bis 93 %. Inwiefern die Schätzungen des IHME präzise sind, ist jedoch unklar: So hat das IHME für Deutschland im Jahr 2019 einen Keuchhusten-Todesfall angegeben, im infektionsepidemiologischen Jahrbuch des RKI für 2019 wurde jedoch kein solcher Todesfall aufgeführt. Die Angaben unterscheiden sich zudem stark von denen der WHO: Für 2018 gibt das IHME 112.958 Todesfälle an – die WHO insgesamt nur 151.074 gemeldete Erkrankungen (Robert Koch-Institut, 2019b; Our World in Data, 2021).
Abbildung 3: Schätzungen der Todesfälle durch Keuchhusten des IHME, weltweit nach Alter, 1990 bis 2019 (Our World in Data, 2021).
- Die genaue Zahl der weltweiten (Todes-)Fälle ist letztlich nicht bekannt. Modellrechnungen kommen auf einen durchschnittlichen jährlichen Wert von 24,1 Millionen weltweiten Fälle, wovon ca. 160.700 Todesfälle sein sollen. Die Spannweite ist dabei mit 7 bis 40 Millionen Fällen (38.000 bis 670.000 Todesfälle) recht groß (Coutte & Locht, 2015; Yeung et al., 2017).
- Die afrikanischen Regionen bzw. Low- and Middle Income Countries (LMICs) generell machen dabei den größten Anteil der (Todes-)Fälle aus. Die WHO schätzt, dass über 90 % der Todesfälle in LMICs zu verorten sind (Muloiwa et al., 2015; Yeung et al., 2017).
- Die CDC geben an, dass für die USA im Zeitraum 2000 bis 2017 307 Keuchhusten assoziierte Todesfälle gemeldet wurden. 84 % der Todesfälle betrafen Kinder im Alter von unter 2 Monaten. Die durchschnittliche jährliche Anzahl an Keuchhustenfälle wird in diesem Zeitraum mit 2.957 angegeben, die Zahl der Krankenhausaufenthalte mit 1.122 (Centers for Disease Control and Prevention, 2022b).
- In Deutschland wurden seit Einführung der Keuchhusten-Meldepflicht im Jahr 2013 durchschnittlich 11 bis 20 Erkrankungen pro 100.000 Einwohnern gemeldet. Säuglinge weisen dabei mit 100 Erkrankungen pro 100.000 Einwohnern eine deutlich höhere Inzidenz auf. Trotz niedrigerer Inzidenz bei Erwachsenen treten mittlerweile 60 % aller Erkrankungen bei Personen im Alter ≥ 18 Jahre auf. Ein möglicher Grund dafür sind fehlende Auffrischimpfungen (Robert Koch-Institut, 2022).
- Insgesamt traten nur 10 Todesfälle seit Beginn der Meldepflicht in Deutschland auf, davon alleine 5 im Jahr 2016 (Deutsches Ärzteblatt, 2022).
- Keuchhusten-Fälle treten ganzjährig auf, die Inzidenz ist im Herbst und Winter aber etwas höher (Deutsches Ärzteblatt, 2022).
- In den letzten Jahren kam es in den einkommensstarken Ländern (HICs) zu einem Wiederanstieg der gemeldeten Keuchhustenfälle wie zuletzt in den 1950er-Jahren (Scanlon et al., 2015). Als Gründe dafür wurden Veränderungen des Bakteriums, bessere diagnostische Möglichkeiten, aber auch nachlassende Impfeffektivität bzw. Immunität postuliert. Es gibt Hinweise darauf, dass die Umstellung von den alten Ganzzellimpfstoffen zu den neuen azellulären Impfstoffen zu einem noch schnelleren Abklingen der Immunität geführt hat (s. Keuchhusten: Die Impfung) (Nieves & Heininger, 2016).
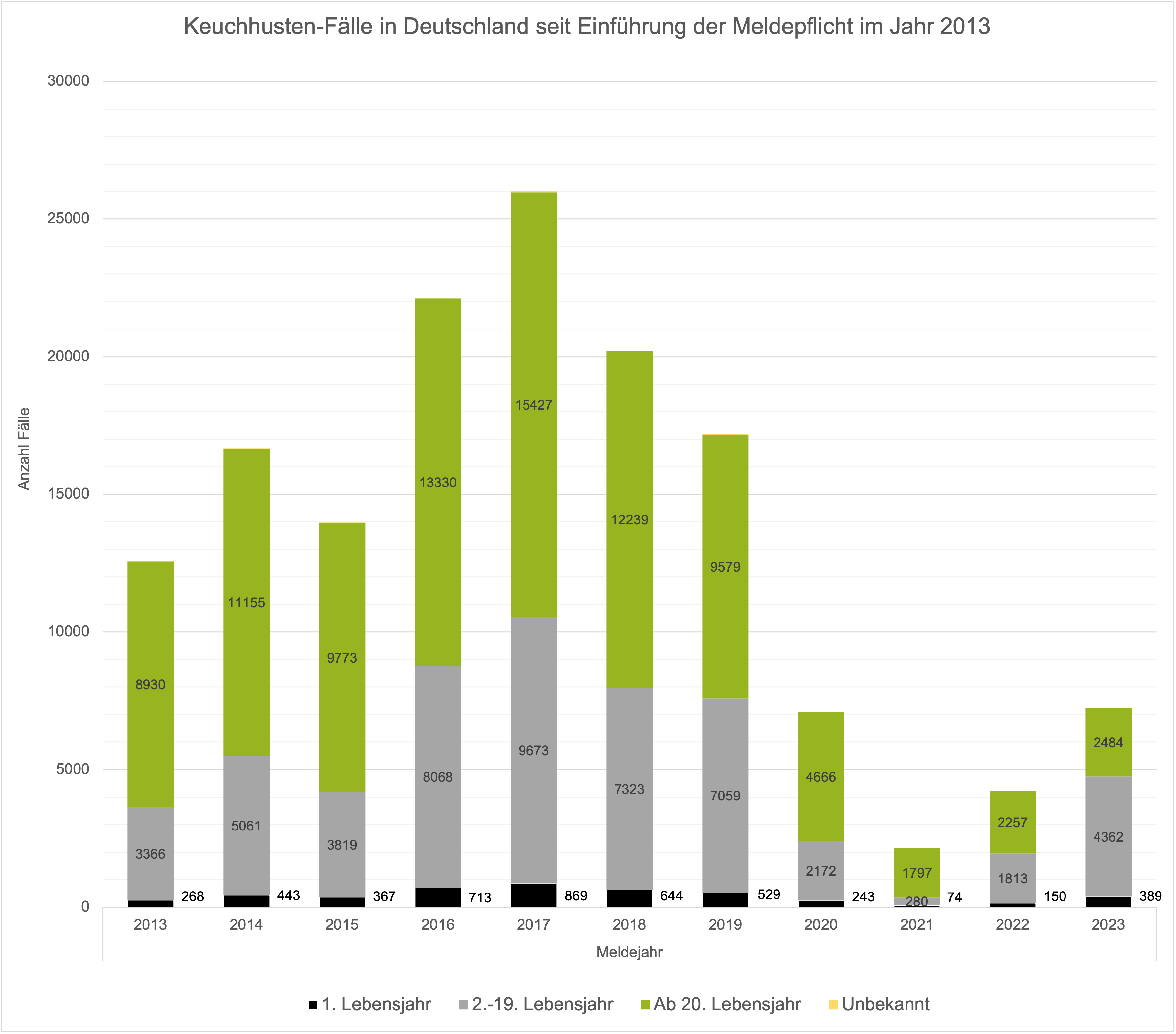 Abbildung 4: Anzahl der dem RKI gemeldeten jährlichen Keuchhusten-Fälle in Deutschland seit Einführung der Meldepflicht nach IfSG im Jahr 2013 (Robert Koch-Institut, 2023b).
Abbildung 4: Anzahl der dem RKI gemeldeten jährlichen Keuchhusten-Fälle in Deutschland seit Einführung der Meldepflicht nach IfSG im Jahr 2013 (Robert Koch-Institut, 2023b). - Keuchhusten: Die Impfung
Die Impfung
- In Deutschland ist kein Einzelimpfstoff gegen Keuchhusten zugelassen. Alle Impfstoffe enthalten mindestens auch eine Komponente gegen Tetanus und Diphtherie
- Gegen Keuchhusten kann ab einem Alter von 2 Monaten geimpft werden
- Die Impfquote bei Schulanfängern in Deutschland lag 2018 bei ca. 93 % (Robert Koch-Institut, 2019a).
Impfstoffname
Komponenten
Zugelassen ab (Alter)
Besonderheit
Boostrix
Diphtherie, Tetanus, Pertussis
4 Jahren
Auffrischimpfstoff
Boostrix Polio
Diphtherie, Tetanus, Pertussis, Polio
3 Jahren
Covaxis
Diphtherie, Tetanus, Pertussis
4 Jahren
Auffrischimpfstoff
Hexacima
Diphtherie, Tetanus, Pertussis, Polio, HiB, Hepatitis B
6 Wochen
Hexyon
Diphtherie, Tetanus, Pertussis, Polio, HiB, Hepatitis B
7 Wochen
Infanrix
Diphtherie, Tetanus, Pertussis
2 Monaten -6 Jahren
Infanrix hexa
Diphtherie, Tetanus, Pertussis, Polio, HiB, Hepatitis B
2 Monaten
Infanrix-IPV + HiB
Diphtherie, Tetanus, Pertussis, Polio, HiB
2 Monaten
Pentavac
Diphtherie, Tetanus, Pertussis, Polio, HiB
2 Monaten
Repevax
Diphtherie, Tetanus, Pertussis, Polio
3 Jahren
Auffrischimpfstoff
TdaP-IMMUN
Diphtherie, Tetanus, Pertussis
4 Jahren
Auffrischimpfstoff
Tetravac
Diphtherie, Tetanus, Pertussis, Polio
2 Monaten
(derzeit nicht vermarktet)
Vaxelis
Diphtherie, Tetanus, Pertussis, Polio, HiB, Hepatitis B
6 Wochen
Tabelle 2: In Deutschland zugelassene Kombinationsimpfstoffe, die eine Komponente gegen Pertussis (Keuchhusten) enthalten. Die Tabelle spiegelt nicht unbedingt die aktuelle Marktsituation wider (Paul-Ehrlich-Institut, 2023b).
Wirksamkeit
Alter (Ganzzell-)Impfstoff
- Bis 1998 gab es einen Ganzzell-Impfstoff, der allerdings schlecht verträglich war und zu häufigen, teils schweren Nebenwirkungen, wie z.B. Hypoton-Hyporesponsive Episoden (HHE) führte, was wiederum teilweise bleibende Schäden wie Epilepsie oder Behinderung bedingte (DuVernoy et al., 2000)
Neuer (TDaP-)Impfstoff
- Verschiedene Studien ergaben einen Impfschutz von 53-59 % bzw. 53-64 % für Säuglinge, Jugendliche und Erwachsene bei der TDaP-Impfung (Ad hoc group, 1988; Baxter et al., 2013).
- Durch die Impfung kann die Zirkulation des Bakteriums in der Bevölkerung nicht verhindert werden (EMA, 2023; Paul-Ehrlich-Institut, 2023a). Geimpfte können asymptomatisch erkranken und somit Ungeimpfte unbemerkt anstecken (Althouse & Scarpino, 2015). Eine Herdenimmunität kann also mit den vorhandenen Impfstoffen nicht erreicht werden.
- Es kann kein langfristiger Schutz aufgebaut werden (Burdin et al., 2017). Eine Meta-Analyse konnte eine nur etwa 3 Jahre anhaltende Wirksamkeit der TDaP-Impfstoffe, unerheblich ob nach einem Schema mit 3 oder 5 Impfstoffdosen, feststellen (McGirr & Fisman, 2015; Nieves & Heininger, 2016).
- Es gibt seit einigen Jahren in Ländern mit dem neueren azellulären Impfstoff einen Anstieg der Erkrankungszahlen. Mögliche Gründe dafür könnten die nachlassende Immunität in der Bevökerung sein oder der Umstand, dass sich Bordetella pertussis durch die vermehrten Impfungen evolutionär weiterentwickelt und dadurch die aP-Impfstoffe nicht mehr wirken (Sealey et al., 2015, 2016)
- Außerdem könnte durch die aP-Impfung die Anfälligkeit für Infektionen mit B. parapertussis ansteigen, das ein ähnliches, aber milderes Krankheitsbild verursacht (Long et al., 2010)
Schwangere
- Ein systematisches Review mit Meta-Analyse von 2017 folgert, es gebe Hinweise darauf, dass Keuchhusten-Impfungen, die in der 19. Bis 37. SSW verabreicht werden, im Vergleich zum Placebo signifikant höhere Antikörperspiegel im Blut der Mütter und ihrer Neugeborenen produzieren. Bisher gebe es jedoch keine belastbare Evidenz, dass die erhöhten Antikörperspiegel die Inzidenz, schwere Komplikationen oder die Sterblichkeit durch Keuchhusten verringern können. (Furuta et al., 2017).
- Vorhandene Studien, die eine relative Risikoreduktion für eine Infektion mit Keuchhusten bei Säuglingen durch eine Impfung von Müttern während der Schwangerschaft aufzeigen, sind u. a. durch sehr große Vertrauensbereiche und geringe Stichprobengrößen stark limitiert (Merdrignac et al., 2022).
- Weiterhin muss beachtet werden, dass es zu einer Abstumpfungswirkung („blunting“) durch die maternale Impfung kommen könnte, was bedeutet, dass es nach der Impfung in der Schwangerschaft womöglich zu einer verringerten immunologischen Reaktion nach der Impfung des Kindes kommt. Die Häufigkeit sowie das Ausmaß dieses Effektes sind bisher nicht geklärt. Einige Forscher nehmen eine Verringerung der Impfeffektivität um 10-20 % an (Martinón-Torres et al., 2021; Briga et al., 2023; Knuutila et al., 2023).
Kokonstrategie
- Weil Säuglinge im Alter von bis zu vier bis sechs Monaten bei einer Keuchhusteninfektion die meisten Komplikationen entwickeln, in diesem Zeitraum der Impfschutz aber nicht vollständig sein kann, empfiehlt die STIKO allen Erwachsenen im Umfeld des Säuglings, sich impfen zu lassen (STIKO, 2020).
- Hinsichtlich des nicht eintretenden Herdenschutzes und des vermehrten Auftretens asymptomatischer Keuchhusteninfektionen bei Geimpften ist der Nutzen dieser Strategie jedoch fraglich. Verschiedene Studien kamen in diesem Zusammenhang beispielsweise zu dem Ergebnis, dass die wichtigste Ansteckungsquelle für Säuglinge in den ersten sechs Lebensmonaten ihre vollständig geimpften Geschwister sind (Bertilone et al., 2014)
- Hinzu kommt, dass die Kokon-Strategie in der Praxis schwer umzusetzen ist. Eine Querschnittstudie aus der Schweiz ergab, dass bei 93 % der Familien die Kokon-Strategie nicht vollständig umgesetzt wurde und unter 50 % der engen Kontaktpersonen gegen Pertussis geimpft waren (Urwyler & Heininger, 2014).
- Auch die WHO rät von der Kokonstrategie ab (WHO, 2015).
Nebenwirkungen
Hinweis: Um die Tabelle vollständig anzuzeigen, scrollen Sie bitte mit Maus oder Touchpad nach rechts und links.
Boostrix
Boostrix Polio
Covaxis
Hexacima
Hexyon
Sehr häufig (>1/10)
Reizbarkeit, Schläfrigkeit, Kopfschmerzen, Reaktionen an der Injektionsstelle (wie Rötung und/oder Schwellung), Schmerzen an der Injektionsstelle, Müdigkeit, Unwohlsein
Schläfrigkeit, Kopfschmerzen, Reaktionen an der Injektionsstelle (wie Rötung und/oder Schwellung), Schmerzen an der Injektionsstelle, Müdigkeit, Unwohlsein
Appetitlosigkeit, Kopfschmerzen, Generalisierter Muskelschmerz oder Muskelschwäche, Arthralgie oder Gelenkschwellung, Müdigkeit, Abgeschlagenheit, Krankheitsgefühl, Schüttelfrost, Schmerz, Erythem oder Schwellung an der Injektionsstelle
Appetitlosigkeit, Schreien, Schläfrigkeit, Erbrechen, Schmerz, Erythem und Schwellung an der Injektionsstelle, Reizbarkeit, Fieber (> 38°C)
Appetitlosigkeit, Schreien, Schläfrigkeit, Erbrechen, Schmerz, Erythem und Schwellung an der Injektionsstelle, Reizbarkeit, Fieber (>38 °C)
Häufig (≥ 1/100 bis < 1/10)
Lymphadenopathie, Appetitlosigkeit, Kopfschmerzen, Schwindel, Durchfall, Erbrechen, gastrointestinale Beschwerden, Übelkeit, Fieber >= 37,5 °C, einschließlich Fieber > 39 °C, ausgedehnte Schwellung der Extremität, an der die Impfung vorgenommen wurde (manchmal unter Einbeziehung des angrenzenden Gelenks), Reaktionen an der Injektionsstelle
Appetitlosigkeit, Reizbarkeit, Fieber >= 37,5 °C, einschließlich Fieber > 39 °C, Schüttelfrost, Schmerzen, ausgedehnte Schwellung der Extremität, an der die Impfung vorgenommen wurde (manchmal unter Einbeziehung des angrenzenden Gelenks), Reaktionen an der Injektionsstelle (wie Blutung, Pruritus und Verhärtung, Wärme, Taubheit, steriler Abszess)
Durchfall, Übelkeit, Ausschlag, Fieber, Schüttelfrost, axilläre Lymphadenopathie
ungewöhnliches Schreien (anhaltendes Schreien), Induration an der Injektionsstelle
ungewöhnliches Schreien (anhaltendes Schreien), Durchfall, Induration an der Injektionsstelle
Gelegentlich (≥ 1/1.000 bis < 1/100)
Infektion der oberen Atemwege, Pharyngitis, Aufmerksamkeits-störungen, Synkope, Konjunktivitis, Husten, Hautausschlag, Hyperhidrose, Pruritus, Arthralgie, Myalgie, Gelenksteife, Steifheit der Skelettmuskulatur, andere Reaktionen an der Injektionsstelle (wie Verhärtung), Schmerzen, grippeähnliche Beschwerden
Herpes labialis, Infektion der oberen Atemwege, Pharyngitis, Lymphadenopathie, Schlafstörung, Apathie, Parästhesie, Schläfrigkeit, Schwindel, Aufmerksamkeits-störungen, Synkope, Konjunktivitis, Trockener Rachen, Asthma, Husten, Durchfall, Erbrechen, Bauchschmerzen, Übelkeit, Gastrointestinale Störungen, Pruritus, Hautausschlag, Hyperhidrose, Arthralgie, Myalgie, Gelenksteife, Steifheit der Skelettmuskulatur, Müdigkeit, grippeähnliche Beschwerden
Erbrechen
Durchfall, Knötchen an der Injektionsstelle, Fieber (>= 39,6°C), Überempfindlichkeitsreaktion
Knötchen an der Injektionsstelle, Fieber (> 39,6°C), Überempfindlichkeitsreaktion
Selten (≥ 1/10.000, < 1/1.000)
Hautausschlag, starke Schwellung der betroffenen Extremität
Krampfanfälle mit oder ohne Fieber, Hautausschlag, starke Schwellung der betroffenen Extremität, anaphylaktische Reaktion
Sehr selten (< 1/10.000)
aufsteigende Lähmung, Atemlähmung, Guillain-Barré-Syndrom
Muskelhypotonie oder hypoton-hyporesponsive Episoden (HHE)
Muskelhypotonie oder hypoton-hyporesponsive Episoden (HHE)
Unbekannt / Post-Marketing-Surveillance
Hypoton-hyporesponsive Episoden, Krampanfälle (mit oder ohne Fieber), Urtikaria, Angioödem, Asthenie, allergische Reaktionen einschließlich anaphylaktische und anaphylaktoide Reaktionen
Hypoton-hyporesponsive Episoden, Krampfanfälle (mit oder ohne Fieber), Urtikaria, Angioödem, Asthenie, allergische Reaktionen einschließlich anaphylaktische und anaphylaktoide Reaktionen
Parästhesie, Hypästhesie, Guillain-Barré-Syndrom, Plexus-brachialis-Neuritis, Gesichtslähmung, Krampfanfall, Synkope, Myelitis, Pruritus, Urtikaria, Myositis, Bluterguss oder steriler Abszess an der Injektionsstelle, anaphylaktische Reaktion, Angioödem, Ödem, Ausschlag, Hypotonie, Myokarditis
Infanrix
Infanrix hexa
Infanrix-IPV+HiB
Pentavac
Repevax
Sehr häufig (>1/10) Reizbarkeit, Somnolenz, Rötung und Schwellung an der Injektionsstelle, Fieber >= 38°C
Appetitlosigkeit, ungewöhnliches Schreien, Reizbarkeit, Ruhelosigkeit, Schläfrigkeit, Fieber ≥38 °C, Schmerzen, Rötung, Schwellung an der Injektionsstelle (bis 50 mm)
Appetitlosigkeit, ungewöhnliches Schreien, Reizbarkeit, Ruhelosigkeit, Somnolenz, Fieber (≥ 38°C), Reaktionen an der Injektionsstelle wie Schmerzen, Rötung, Schwellung (bis 50 mm)
Appetitlosigkeit, Nervosität (Reizbarkeit), ungewöhnliches Schreien, Schläfrigkeit (Benommenheit), Erbrechen, Rötung an der Injektionsstelle, Fieber > 38 °C, Schwellung und Schmerz an der Injektionsstelle
Kopfschmerz, Durchfall, Übelkeit, Arthralgie/Gelenk-schwellung, Myalgie, Müdigkeit/ Abgeschlagenheit, Fieber, Schüttelfrost, Schmerz an der Injektionsstelle, Schwellung an der Injektionsstelle, Rötung an der Injektionsstelle
Häufig (≥ 1/100 bis < 1/10) Appetitverlust, Unruhe, ungewöhnliches Schreien, Durchfall, Erbrechen, Pruritus, Schmerzen, Schwellung an der Injektionsstelle (über 50 mm)
Unruhe, Durchfall, Erbrechen, Fieber >39,5 °C, Reaktionen an der Injektionsstelle, einschließlich Verhärtung, Schwellung an der Injektionsstelle über 50 mm)
Durchfall, Erbrechen, Reaktionen an der Injektionsstelle einschließlich Verhärtung, Schwellung (über 50 mm)
Schlaflosigkeit (Schlafstörung), Durchfall, Verhärtung an der Injektionsstelle
Erbrechen, Ausschlag, Reizbarkeit, Dermatitis oder Hämatom an der Injektionsstelle, Juckreiz an der Injektionsstelle
Gelegentlich (≥ 1/1.000 bis < 1/100) Kopfschmerzen, Husten, Bronchitis, Hautausschlag, Reaktionen an der Injektionsstelle, Verhärtung, Mattigkeit, Fieber >= 39,1°C, diffuse Schwellung der Extremität, an der die Injektion vorgenommen wurde - mitunter unter Einbeziehung des angrenzenden Gelenks
Infektion der oberen Atemwege, Husten, diffuse Schwellung der Extremität, an der die Injektion vorgenommen wurde, manchmal unter Einbeziehung des angrenzenden Gelenks, Müdigkeit
Infektion der oberen Atemwege, Lymphadenopathie, Bronchitis, Husten, Schnupfen, Urtikaria, Hautausschlag, diffuse Schwellung der Extremität, an der die Injektion vorgenommen wurde - mitunter unter Einbezug des angrenzenden Gelenkes, Fieber > 39,5°C, Müdigkeit
langanhaltendes, unstillbares Schreien
Selten (≥ 1/10.000, < 1/1.000) Urtikaria
Lymphadenopathie, Thrombozytopenie, anaphylaktische Reaktionen, Kollaps oder schockähnlicher Zustand (hypoton-hyporesponsive Episode, anaphylaktoide Reaktionen (einschließlich Urtikaria), allergische Reaktionen (einschließlich Pruritus), Bronchitis, Apnoe (Frühgeborene), Hautausschlag, Angioödem, Schwellung der gesamten Extremität, an der die Injektion vorgenommen wurde, ausgedehnte Schwellung, Verhärtung oder Bläschen an der Injektionsstelle
Pruritus, Dermatitis
hohes Fieber > 40 °C, ödematöse Reaktion der unteren Gliedmaßen nach Gabe
von Haemophilus-influenzae-Typ-b-Konjugat-Impfstoffen. Hierbei treten
innerhalb der ersten Stunden nach der Impfung Ödeme begleitet von Zyanose,
Rötung, transienter Purpura und heftiges Schreien auf. Alle Reaktionen bilden
sich spontan und ohne Folgen innerhalb von 24 Stunden zurück.
Sehr selten (< 1/10.000) Lymphadenopathie, allergische Reaktionen (anaphylaktische, anaphylaktoide Reaktionen)
Krampfanfälle (mit oder ohne Fieber), Dermatitis
Unbekannt / Post-Marketing-Surveillance Thrombozytopenie (bei Tetanus- und Diphtheriehaltigen Impfstoffen), Kollaps oder schockähnlicher Zustand (hypotone-hyporesponsive Episode), Krampfanfälle (mit oder ohne Fieber) innerhalb von 2-3 Tagen nach der Impfung, Apnoe (Frühgeborene vor 28. SSW), Angioödem, Schwellung der gesamten Extremität, an der die Injektion vorgenommen
anaphylaktische Reaktionen, Gesichtsödem, Quincke-Ödem oder Schock, Krampfanfälle mit oder ohne Fieber, Muskelhypotonien oder hypotonhyporesponsive Episoden (HHE), Hautausschlag, Urtikaria, großflächige Reaktionen an der Injektionsstelle (> 5 cm) einschließlich starker
Schwellungen an der betroffenen Extremität, die sich von der Injektionsstelle
über ein oder beide Gelenke ausdehnen. Diese Reaktionen beginnen 24 bis
72 Stunden nach der Impfung und können mit Erythem, Wärme, Druckempfindlichkeit oder Schmerzen an der Injektionsstelle verbunden sein, Apnoe (Frühgeborene)
Lymphadenopathie, anaphylaktische Reaktionen, wie z.B. Urtikaria, Gesichtsödem und Atemnot, Krampfanfall, vasovagale Synkope, Guillain-Barré Syndrom, Fazialisparese, Myelitis, Plexus-brachialis Neuritis, vorübergehende Parästhesie/Hypästhesie der
Extremität, in die geimpft wurde, Schwindel, Bauchschmerz, Schmerz in der Extremität, in die Geimpft wurde, Krankheitsgefühl, Blässe, starke Schwellung der Extremität, Verhärtung an der Injektionsstelle
TdaP-IMMUN
Tetravac
Vaxelis
Sehr häufig (>1/10) Kopfschmerzen, Schmerzen, Juckreiz, Rötung oder Schwellung an der Injektionsstelle, Müdigkeit
Verminderter Appetit, Somnolenz, Erbrechen, Weinen, Reizbarkeit, Erythem, Schmerz oder Schwellung an der Injektionsstelle, Fieber
Häufig (≥ 1/100 bis < 1/10) Fieber (≥ 38°C), Reizbarkeit und Unwohlsein, Rötung an der Injektionsstelle (≥ 5 cm), Schwellung an der Injektionsstelle (≥ 5 cm), Myalgie
Appetitlosigkeit, Nervosität (Reizbarkeit), Schlaflosigkeit, Schläfrigkeit (Benommenheit), Durchfall, Erbrechen, Rötung, Verhärtung an der Injektionsstelle, Fieber (≥ 40°C)
Diarrhoe, blauer Fleck, Verhärtung oder Knötchen an der Injektionsstelle
Gelegentlich (≥ 1/1.000 bis < 1/100) Langanhaltendes, unstillbares Schreien, Rötung, Schwellung ≥ 5 cm, Fieber (≥ 39°C)
Rhinitis, Lymphadenopathie, Appetitsteigerung, Schlafstörung und Schlaflosigkeit, Unruhe, erniedrigter Muskeltonus, Blässe, Husten, Abdominalschmerz, Ausschlag, Hyperhidrosis, Ausschlag oder Wärme an der Injektionsstelle, Ermüdung
Selten (≥ 1/10.000, < 1/1.000) Urtikaria, Fieber (≥ 40°C), Granulom oder steriler Abszess an der Injektionsstelle
hohes Fieber ≥ 40°C
Überempfindlichkeit, anaphylaktische Reaktion
Sehr selten (< 1/10.000) Überempfindlichkeit, anaphylaktische Reaktionen
Unbekannt / Post-Marketing-Surveillance anaphylaktische Reaktionen, Gesichtsödem, Quincke-Ödem, Krämpfe mit oder ohne Fieber, Ausschlag, Erythem, Urtikaria, Schmerzen an der Injektionsstelle, großflächige Reaktionen an der Injektionsstelle (> 5 cm) einschließlich starker Schwellung an der betroffenen Extremität, die sich von der Injektionsstelle über ein oder beide Gelenke ausdehnen
Tabelle 3: Unerwünschte Arzneimittelwirkungen der in Deutschland zugelassenen Impfstoffe gegen Pertussis (Keuchhusten) (Paul-Ehrlich-Institut, 2023b)
Schwangere
- Ein sehr robustes systematisches Review, dass nach dem GRADE-Ansatz durchgeführt wurde und das Risiko für Verzerrungen nach dem Cochrane Risk of Bias (ROB) Manual ermittelt hat, konnte eine erhöhte Wahrscheinlichkeit des Auftretens von Fieber und Chorioamnionitis feststellen. Es wurde jedoch über keine daraus resultierenden Folgeerscheinungen (z. B. Frühgeburt oder Einweisung in die neonatale Intensivstation) berichtet. Das Risiko für eine Verzerrung wurde (auch für nicht als signifikant beurteilte unerwünschte Wirkungen) als hoch bis kritisch eingestuft. Die Studienautoren empfehlen eine kontinuierliche Überwachung der Chorioamnionitis und ihrer möglichen Folgen (Vygen-Bonnet et al., 2020).
- Ein weiteres systematisches Review mit Meta-Analyse kann diesen Fund (erhöhtes Risiko für Chorioamnionitis) bestätigen. Aufgrund der hohen Anzahl an Müttern, die diese Impfung erhalten, empfehlen die Forscher die Konzeption und Durchführung randomisierter-kontrollierter Studien (RCTs), um unerwünschte Wirkungen der maternalen Impfung besser bewerten zu können (Andersen et al., 2022).
- Bisher konnte laut einem systematischen Review mit Meta-Analyse von 2017 kein erhöhtes Risiko für Totgeburten oder Frühgeburten durch die Keuchhusten-Impfung entdeckt werden (Furuta et al., 2017).
- Wie bei anderen Impfstoffen auch, weisen die TDaP-Impfstoffe Aluminium als Wirkverstärker auf. Da es sich dabei um eine allgemein als neurotoxisch anerkannte Substanz handelt, die es in der pränatalen und perinatalen Phase unbedingt zu vermeiden gilt (Fanni et al., 2014), sind unbedingt Impfstoffe ohne entsprechende Substanzen notwendig.
- Keuchhusten: Die STIKO-Empfehlung
Die Empfehlungen
- Die STIKO empfiehlt allen Säuglingen und Kleinkindern eine Grundimmunisierung mit den vorhandenen Kombinationsimpfstoffen, u. a. um Impfungen und Impftermine zu sparen.
- Je nach verwendetem Kombinationsimpfstoff sollen unterschiedliche Schemata angewandt werden.
- Seit dem 25. Juni 2020 empfiehlt die STIKO bei Verwendung des 6-fach-Impfstoffes das neue, reduzierte 2+1-Schema. Die beiden ersten Impfungen sind dann im Alter von 2 und 4 Monaten, die dritte Impfung im Alter von 11 Monaten zu verabreichen. Zwischen der zweiten und dritten Impfung soll ein Abstand von mindestens 6 Monaten eingehalten werden.
- Frühgeborene sollen aufgrund des noch nicht ausgereiften Immunsystems die 6-fach-Impfung auch weiterhin nach dem 3+1-Schema erhalten: Die Impfzeitpunkte sind dann im Alter von 2, 3, 4 und 11 Monaten. Zwischen den ersten drei Impfungen soll ein Mindestabstand von 4 Wochen eingehalten werden.
- Von den 5-fach-Impfstoffen ist nur Infanrix-IPV+Hib für das 2+1-Schema zugelassen.
- Auffrischimpfungen sind im Vorschul- und Jugendalter empfohlen.
- Erwachsene sollen bei der nächsten Tetanus- und Diphtherie-Auffrischungsimpfung auch gegen Keuchhusten geimpft werden.
- Personal im Gesundheitsdienst sowie in Gemeinschaftseinrichtungen sollen alle 10 Jahre eine Dosis Pertussis-Impfstoff erhalten.
- Zusätzlich wird nun auch Schwangeren im dritten Trimenon empfohlen, sich gegen Pertussis impfen zu lassen, um einen Schutz für das Neugeborene in den ersten Lebensmonaten aufzubauen. Ist eine Frühgeburt abzusehen, soll die Impfung in das zweite Trimenon vorgezogen werden.
- Letztlich empfiehlt die STIKO als Maßnahme zum Schutz von Neugeborenen die „Kokon-Strategie“: Es sollen möglichst viele Personen, die Kontakt zum (noch) ungeimpften Neugeborenen haben, geimpft werden, um einen Herdenschutz im Umfeld zu erreichen (Robert Koch-Institut, 2020).
(Robert Koch-Institut, 2023a)
Kritik an den STIKO-Empfehlungen
- Trotz neuer TDaP-Impfstoffe und hoher Impfquote (93 % der Schulanfänger waren 2018 geimpft) sind die Erkrankungszahlen nicht konsequent rückläufig. Dies liegt wahrscheinlich auch daran, dass die zur Verfügung stehenden Impfstoffe keine langfristige Immunität und auch keine Herdenimmunität vermitteln.
- Dass asymptomatische bzw. untypische Verläufe bei Kindern, Jugendlichen und Erwachsenen sehr häufig sind, bedeutet für die Gesamtbevölkerung, dass die Erkrankung in dieser Population in der Regel ungefährlich ist. Die Impfstrategie der STIKO ist hier generell in ihrem Nutzen zu überdenken.
- Die STIKO sollte unbedingt die Herstellung und Zulassung eines Einzelimpfstoffes ohne Aluminium-Adjuvantien empfehlen.
- Der Nutzen der Kokon-Strategie ist in der aktuellen evidenzbasierten Literatur nicht erwiesen – auch die WHO rät davon ab.
- Um junge Säuglinge vor einem schweren Verlauf zu schützen, sind neben präzisen Falldefinitionen auch neue Diagnose- und Therapiemethoden wichtig. Eine Impfung kann dahingehend eine falsche Sicherheit vermitteln, dass z. B. geimpfte Geschwister nicht als Überträger infrage kommen. Dabei ist eine frühzeitige Diagnose und Therapie für die Prognose entscheidend (Scanlon et al., 2015; van der Zee et al., 2015).
Eine Empfehlung zur Beratung werdender Mütter über ein verändertes Kontaktverhalten von Familie und Besuchern könnte helfen, das Risiko für einen schweren Verlauf bei jungen Säuglingen zu verringern.
- Eine Studie mit Näherungssensoren (RFID-Technologie) konnte in Haushalten mit Kleinkindern unter 6 Monaten (Nah-)Interaktionen und Kontaktnetzwerke evaluieren. Insbesondere Mütter scheinen dabei für den Großteil der Kontaktmuster verantwortlich zu sein, was darauf hindeutet, dass sie die wichtigste Infektionsquelle für eine übertragbare Infektionskrankheit bei Säuglingen darstellen (Ozella et al., 2018).
- Eine weitere Studie zur Evaluierung sozialer Kontaktmuster von Säuglingen, in welcher auch Kontakte mit Schulkindern, die Häufigkeit des Besuchs von belebten Plätzen und das Alter als signifikante Faktoren für die Meldung von Atemwegssymptomen bei Säuglingen ermittelt wurden, kommt zu dem Ergebnis, dass der Besuch von belebten Plätzen, Geschwister im Schulalter sowie Mütter das höchste Infektionsrisiko aufweisen (Oguz et al., 2018).
- Literaturverzeichnis
Ad hoc group. (1988). Placebo-controlled trial of two acellular pertussis vaccines in Sweden—Protective efficacy and adverse events. Ad Hoc Group for the Study of Pertussis Vaccines. Lancet (London, England), 1(8592), 955–960.
Althouse, B. M., & Scarpino, S. V. (2015). Asymptomatic transmission and the resurgence of Bordetella pertussis. BMC Medicine, 13, 146. https://doi.org/10.1186/s12916-015-0382-8
Andersen, A. R., Kolmos, S. K., Flanagan, K. L., & Benn, C. S. (2022). Systematic review and meta-analysis of the effect of pertussis vaccine in pregnancy on the risk of chorioamnionitis, non-pertussis infectious diseases and other adverse pregnancy outcomes. Vaccine, 40(11), 1572–1582. https://doi.org/10.1016/j.vaccine.2021.02.018
Barger-Kamate, B., Deloria Knoll, M., Kagucia, E. W., Prosperi, C., Baggett, H. C., Brooks, W. A., Feikin, D. R., Hammitt, L. L., Howie, S. R. C., Levine, O. S., Madhi, S. A., Scott, J. A. G., Thea, D. M., Amornintapichet, T., Anderson, T. P., Awori, J. O., Baillie, V. L., Chipeta, J., DeLuca, A. N., … Pneumonia Etiology Research for Child Health (PERCH) Study Group. (2016). Pertussis-Associated Pneumonia in Infants and Children From Low- and Middle-Income Countries Participating in the PERCH Study. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, 63(suppl 4), S187–S196. https://doi.org/10.1093/cid/ciw546
Baxter, R., Bartlett, J., Rowhani-Rahbar, A., Fireman, B., & Klein, N. P. (2013). Effectiveness of pertussis vaccines for adolescents and adults: Case-control study. BMJ, 347, f4249. https://doi.org/10.1136/bmj.f4249
Bertilone, C., Wallace, T., & Selvey, L. A. (2014). Finding the „who“ in whooping cough: Vaccinated siblings are important pertussis sources in infants 6 months of age and under. Communicable Diseases Intelligence Quarterly Report, 38(3), E195-200.
Briga, M., Goult, E., Brett, T. S., Rohani, P., & Cellès, M. D. de. (2023). Does maternal immunization blunt the effectiveness of pertussis vaccines in infants? Too early to tell (S. 2023.06.08.23291137). medRxiv. https://doi.org/10.1101/2023.06.08.23291137
Burdin, N., Handy, L. K., & Plotkin, S. A. (2017). What Is Wrong with Pertussis Vaccine Immunity? Cold Spring Harbor Perspectives in Biology, 9(12), a029454. https://doi.org/10.1101/cshperspect.a029454
Carbonetti, N. H. (2016). Pertussis leukocytosis: Mechanisms, clinical relevance and treatment. Pathogens and Disease, 74(7), ftw087. https://doi.org/10.1093/femspd/ftw087
Centers for Disease Control and Prevention. (2022a, September 16). Pertussis: Clinical Features. CDC. https://www.cdc.gov/pertussis/clinical/features.html
Centers for Disease Control and Prevention. (2022b, Oktober 19). Pertussis. Pinkbook. https://www.cdc.gov/vaccines/pubs/pinkbook/pert.html
Coutte, L., & Locht, C. (2015). Investigating pertussis toxin and its impact on vaccination. Future Microbiology, 10(2), 241–254. https://doi.org/10.2217/fmb.14.123
Craig, R., Kunkel, E., Crowcroft, N. S., Fitzpatrick, M. C., de Melker, H., Althouse, B. M., Merkel, T., Scarpino, S. V., Koelle, K., Friedman, L., Arnold, C., & Bolotin, S. (2020). Asymptomatic Infection and Transmission of Pertussis in Households: A Systematic Review. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, 70(1), 152–161. https://doi.org/10.1093/cid/ciz531
Curtis, C. R., Baughman, A. L., DeBolt, C., Goodykoontz, S., Kenyon, C., Watson, B., Cassiday, P. K., Miller, C., Pawloski, L. C., Tondella, M.-L. C., & Bisgard, K. M. (2017). Risk Factors Associated With Bordetella pertussis Among Infants ≤4 Months of Age in the Pre-Tdap Era: United States, 2002-2005. The Pediatric Infectious Disease Journal, 36(8), 726–735. https://doi.org/10.1097/INF.0000000000001528
Cutchin, S. B., & Newlove, M. (2016). Detail – Public Health Image Library(PHIL). Centers for Disease Control and Prevention. https://phil.cdc.gov/Details.aspx?pid=22874
Deutsches Ärzteblatt. (2022, Juli 14). Seit 2013 mehr als 90.000 Keuchhustenfälle in Deutschland. Deutsches Ärzteblatt. https://www.aerzteblatt.de/nachrichten/135962/Seit-2013-mehr-als-90-000-Keuchhustenfaelle-in-Deutschland
DuVernoy, T. S., Braun, M. M., & the VAERS Working Group. (2000). Hypotonic–Hyporesponsive Episodes Reported to the Vaccine Adverse Event Reporting System (VAERS), 1996–1998. Pediatrics, 106(4), e52–e52. https://doi.org/10.1542/peds.106.4.e52
EMA. (2023, April 26). First vaccine to protect older adults from respiratory syncytial virus (RSV) infection [Text]. European Medicines Agency. https://www.ema.europa.eu/en/news/first-vaccine-protect-older-adults-respiratory-syncytial-virus-rsv-infection
Fanni, D., Ambu, R., Gerosa, C., Nemolato, S., Iacovidou, N., Van Eyken, P., Fanos, V., Zaffanello, M., & Faa, G. (2014). Aluminum exposure and toxicity in neonates: A practical guide to halt aluminum overload in the prenatal and perinatal periods. World Journal of Pediatrics: WJP, 10(2), 101–107. https://doi.org/10.1007/s12519-014-0477-x
Freudenberg, M. A. (2004). Die Rolle von Lipopolysaccharid im Wechselspiel zwischen Bakterien und Immunsystem. Max-Planck-Institut für Immunbiologie und Epigenetik. https://www.ie-freiburg.mpg.de/8086/research_report_819084?c=723550
Furuta, M., Sin, J., Ng, E. S. W., & Wang, K. (2017). Efficacy and safety of pertussis vaccination for pregnant women – a systematic review of randomised controlled trials and observational studies. BMC Pregnancy and Childbirth, 17, 390. https://doi.org/10.1186/s12884-017-1559-2
Gill, C. J., Gunning, C. E., MacLeod, W. B., Mwananyanda, L., Thea, D. M., Pieciak, R. C., Kwenda, G., Mupila, Z., & Rohani, P. (2021). Asymptomatic Bordetella pertussis infections in a longitudinal cohort of young African infants and their mothers. eLife, 10, e65663. https://doi.org/10.7554/eLife.65663
Hewlett, E. L., Burns, D. L., Cotter, P. A., Harvill, E. T., Merkel, T. J., Quinn, C. P., & Stibitz, E. S. (2014). Pertussis Pathogenesis—What We Know and What We Don’t Know. The Journal of Infectious Diseases, 209(7), 982–985. https://doi.org/10.1093/infdis/jit639
Kilgore, P. E., Salim, A. M., Zervos, M. J., & Schmitt, H.-J. (2016). Pertussis: Microbiology, Disease, Treatment, and Prevention. Clinical Microbiology Reviews, 29(3), 449–486. https://doi.org/10.1128/CMR.00083-15
Knuutila, A., Barkoff, A.-M., Ivaska, L., Tenhu, E., Teräsjärvi, J., van Gageldonk, P., Buisman, A., Mertsola, J., He, Q., & PERISCOPE consortium. (2023). Effect of immunization during pregnancy and pre-existing immunity on diphtheria-tetanus-acellular pertussis vaccine responses in infants. Emerging Microbes & Infections, 12(1), 2204146. https://doi.org/10.1080/22221751.2023.2204146
Lauria, A. M., & Zabbo, C. P. (2023). Pertussis. In StatPearls. StatPearls Publishing. http://www.ncbi.nlm.nih.gov/books/NBK519008/
Locht, C., & Antoine, R. (2021). The History of Pertussis Toxin. Toxins, 13(9), 623. https://doi.org/10.3390/toxins13090623
Long, G. H., Karanikas, A. T., Harvill, E. T., Read, A. F., & Hudson, P. J. (2010). Acellular pertussis vaccination facilitates Bordetella parapertussis infection in a rodent model of bordetellosis. Proceedings of the Royal Society B: Biological Sciences, 277(1690), 2017–2025. https://doi.org/10.1098/rspb.2010.0010
Macina, D., & Evans, K. E. (2021). Pertussis in Individuals with Co-morbidities: A Systematic Review. Infectious Diseases and Therapy, 10(3), 1141–1170. https://doi.org/10.1007/s40121-021-00465-z
Martinón-Torres, F., Halperin, S. A., Nolan, T., Tapiéro, B., Perrett, K. P., de la Cueva, I. S., García-Sicilia, J., Stranak, Z., Vanderkooi, O. G., Kosina, P., Rumlarova, S., Virta, M., Arribas, J. M. M., Miranda-Valdivieso, M., Novas, B. A., Bozensky, J., Ortega, M. J. C., Amador, J. T. R., Baca, M., … Mesaros, N. (2021). Impact of maternal diphtheria-tetanus-acellular pertussis vaccination on pertussis booster immune responses in toddlers: Follow-up of a randomized trial. Vaccine, 39(11), 1598–1608. https://doi.org/10.1016/j.vaccine.2021.02.001
McGirr, A., & Fisman, D. N. (2015). Duration of pertussis immunity after DTaP immunization: A meta-analysis. Pediatrics, 135(2), 331–343. https://doi.org/10.1542/peds.2014-1729
Merdrignac, L., Acosta, L., Habington, A., Garcìa Cenoz, M., Pandolfi, E., Fabiánová, K., Jordan, I., O’Sullivan, N., Navasués, A., Tozzi, A. E., Zavadilová, J., Jané, M., Cotter, S., Pitillas, N. I., Rizzo, C., Křížová, P., Hanslik, T., Muñoz Almagro, C., Pastore, L., … Valenciano, M. (2022). Effectiveness of pertussis vaccination in pregnancy to prevent hospitalisation in infants aged <2 months and effectiveness of both primary vaccination and mother’s vaccination in pregnancy in infants aged 2-11 months. Vaccine, 40(44), 6374–6382. https://doi.org/10.1016/j.vaccine.2022.09.054
Muloiwa, R., Kagina, B. M., Engel, M. E., & Hussey, G. D. (2015). The burden of pertussis in low- and middle-income countries since the inception of the Expanded Programme on Immunization (EPI) in 1974: A systematic review protocol. Systematic Reviews, 4, 62. https://doi.org/10.1186/s13643-015-0053-z
Nascimento, R. M. do, Baptista, P. N., Lopes, K. A. de M., Pimentel, A. M., Cruz, F. da S. P., & Ximenes, R. A. de A. (2021). Protective effect of exclusive breastfeeding and effectiveness of maternal vaccination in reducing pertussis-like illness. Jornal de Pediatria, 97(5), 500–507. https://doi.org/10.1016/j.jped.2020.10.018
Nieves, D., & Heininger, U. (2016). Bordetella pertussis. Microbiology Spectrum, 4(3). https://doi.org/10.1128/microbiolspec.EI10-0008-2015
Oguz, M. M., Camurdan, A. D., Aksakal, F. N., Akcaboy, M., & Altinel Acoglu, E. (2018). Social contact patterns of infants in deciding vaccination strategy: A prospective, cross-sectional, single-centre study. Epidemiology and Infection, 146(9), 1157–1166. https://doi.org/10.1017/S0950268818001048
Our World in Data. (2021). Deaths from whooping cough, by age, World, 1990 to 2019. Our World in Data. https://ourworldindata.org/grapher/deaths-from-whooping-cough-by-age
Ozella, L., Gesualdo, F., Tizzoni, M., Rizzo, C., Pandolfi, E., Campagna, I., Tozzi, A. E., & Cattuto, C. (2018). Close encounters between infants and household members measured through wearable proximity sensors. PloS One, 13(6), e0198733. https://doi.org/10.1371/journal.pone.0198733
Pandolfi, E., Gesualdo, F., Carloni, E., Villani, A., Midulla, F., Carsetti, R., Stefanelli, P., Fedele, G., Tozzi, A. E., & Pertussis Study Group. (2017). Does Breastfeeding Protect Young Infants From Pertussis? Case-control Study and Immunologic Evaluation. The Pediatric Infectious Disease Journal, 36(3), e48–e53. https://doi.org/10.1097/INF.0000000000001418
Parton, R. (1999). Review of the biology of Bordetella pertussis. Biologicals: Journal of the International Association of Biological Standardization, 27(2), 71–76. https://doi.org/10.1006/biol.1999.0182
Paul-Ehrlich-Institut. (2023a, April 28). Meldungen—Zulassung für Impfstoff gegen Respiratorisches Synzytial-Virus (RSV) empfohlen. https://www.pei.de/DE/newsroom/hp-meldungen/2023/230428-zulassung-rsv-impfstoff-empfohlen.html
Paul-Ehrlich-Institut. (2023b, Juli 13). Pertussis-Impfstoffe (Keuchhusten). PEI. https://www.pei.de/DE/arzneimittel/impfstoffe/pertussis-keuchhusten/pertussis-node.html
Robert Koch-Institut. (2019a). Impfquoten bei der Schuleingangsuntersuchung in Deutschland 2017. Epidemiologisches Bulletin 18/2019, 18, 147–153. https://doi.org/10.25646/6120
Robert Koch-Institut. (2020). Epidemiologisches Bulletin 13/2020 (13; Aktuelle Daten und Informationen zu Infektionskrankheiten und Public Health). RKI. https://www.rki.de/DE/Content/Infekt/EpidBull/Archiv/2020/Ausgaben/13_20.pdf%3F__blob%3DpublicationFile
Robert Koch-Institut. (2023a). Empfehlungen der Ständigen Impfkommission beim Robert Koch-Institut 2023. Epidemiologisches Bulletin, 4. https://doi.org/10.25646/10829
Robert Koch-Institut. (2019b). Infektionsepidemiologisches Jahrbuch—2019. Infektionsschutz. https://www.rki.de/DE/Content/Infekt/Jahrbuch/Jahrbuecher/2019.html?nn=2374622
Robert Koch-Institut. (2022, März 2). Keuchhusten (Pertussis). RKI-Ratgeber. https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Pertussis.html#doc2374534bodyText2
Robert Koch-Institut. (2023b, November 2). SurvStat@RKI 2.0. https://survstat.rki.de/.
Scanlon, K. M., Skerry, C., & Carbonetti, N. H. (2015). Novel therapies for the treatment of pertussis disease. Pathogens and Disease, 73(8). https://doi.org/10.1093/femspd/ftv074
Sealey, K. L., Belcher, T., & Preston, A. (2016). Bordetella pertussis epidemiology and evolution in the light of pertussis resurgence. Infection, Genetics and Evolution: Journal of Molecular Epidemiology and Evolutionary Genetics in Infectious Diseases, 40, 136–143. https://doi.org/10.1016/j.meegid.2016.02.032
Sealey, K. L., Harris, S. R., Fry, N. K., Hurst, L. D., Gorringe, A. R., Parkhill, J., & Preston, A. (2015). Genomic analysis of isolates from the United Kingdom 2012 pertussis outbreak reveals that vaccine antigen genes are unusually fast evolving. The Journal of Infectious Diseases, 212(2), 294–301. https://doi.org/10.1093/infdis/jiu665
STIKO. (2020). Wissenschaftliche Begründung für die Empfehlung der Pertussisimpfung mit einem Tdap-Kombinationsimpfstoff in der Schwangerschaft. https://doi.org/10.25646/6584
Trainor, E. A., Nicholson, T. L., & Merkel, T. J. (2015). Bordetella pertussis transmission. Pathogens and Disease, 73(8), ftv068. https://doi.org/10.1093/femspd/ftv068
Urwyler, P., & Heininger, U. (2014). Protecting newborns from pertussis – the challenge of complete cocooning. BMC Infectious Diseases, 14(1), 397. https://doi.org/10.1186/1471-2334-14-397
van der Zee, A., Schellekens, J. F. P., & Mooi, F. R. (2015). Laboratory Diagnosis of Pertussis. Clinical Microbiology Reviews, 28(4), 1005–1026. https://doi.org/10.1128/CMR.00031-15
Vygen-Bonnet, S., Hellenbrand, W., Garbe, E., von Kries, R., Bogdan, C., Heininger, U., Röbl-Mathieu, M., & Harder, T. (2020). Safety and effectiveness of acellular pertussis vaccination during pregnancy: A systematic review. BMC Infectious Diseases, 20(1), 136. https://doi.org/10.1186/s12879-020-4824-3
Warfel, J. M., Beren, J., & Merkel, T. J. (2012). Airborne Transmission of Bordetella pertussis. The Journal of Infectious Diseases, 206(6), 902–906. https://doi.org/10.1093/infdis/jis443
Yeung, K. H. T., Duclos, P., Nelson, E. A. S., & Hutubessy, R. C. W. (2017). An update of the global burden of pertussis in children younger than 5 years: A modelling study. The Lancet. Infectious Diseases, 17(9), 974–980. https://doi.org/10.1016/S1473-3099(17)30390-0
Zhang, S., Xu, H., Zhang, L., & Qiao, Y. (2020). Cervical cancer: Epidemiology, risk factors and screening. Chinese Journal of Cancer Research = Chung-Kuo Yen Cheng Yen Chiu, 32(6), 720–728. https://doi.org/10.21147/j.issn.1000-9604.2020.06.05
Stand: 7. Nov. 2023
Nächste Aktualisierung: 7. Nov. 2024

