Kostenlos: der ÄFI-Newsletter
Bleiben Sie auf dem Laufenden beim Thema
Impfungen & Impfentscheidung und rund um den Verein.
Influenza („echte Grippe“)
Welche Influenza-Viren gibt es? Wie sieht der typische Infektionsverlauf von "echter Grippe" aus? Welche Personengruppen haben ein erhöhtes Risiko für einen schweren Verlauf? Welche Evidenz gibt es zur Wirksamkeit und Sicherheit der vorhandenen Influenza-Impfstoffe? Und wie steht ÄFI zu den STIKO-Empfehlungen? Antworten auf diese und weitere Fragen finden Sie im nachfolgenden Fachbeitrag.
Vorbemerkung
Die folgenden Ausführungen dienen der Information und ersetzen keinesfalls das ärztliche Beratungsgespräch. Hier werden Fakten präsentiert, die Eltern wie auch Ärztinnen und Ärzten in einem Aufklärungsgespräch helfen können. Ärztinnen und Ärzte für individuelle Impfentscheidung e. V. (ÄFI) übernimmt keine Garantie für Vollständigkeit, hat die hier verfügbaren Inhalte jedoch nach bestem Wissen und Gewissen am aktuellen Fach- und Sachstand zusammengetragen. Über die wissenschaftliche Arbeit des Vereins erfahren Sie hier mehr. Der Fachbeitrag wird halbjährlich, zu Beginn und Ende der jeweiligen Saison, aktualisiert. Das dargelegte Wissen entspricht dem Kenntnisstand zum angegebenen Veröffentlichungs- bzw. Aktualisierungsdatum. Weitere Informationen erhalten Sie auch in unserem Podcast.
Im Podcast anhören
Fachbeitrag
- Influenza: Die Erkrankung
Erreger
- Influenza, auch die „echte Grippe“ genannt, ist eine Infektionskrankheit, die durch saisonal auftretende, behüllte, einzelsträngige RNA-Viren der Familie Orthomyxoviridae ausgelöst wird.
- Typisch ist die spikeartige Oberflächenstruktur der Membran. Im Inneren befindet sich das Genom, das aus 8 einzelnen und voneinander unabhängigen RNA-Segmenten besteht (Robert Koch-Institut, 2018).
- Es werden insgesamt vier Typen unterschieden: A, B, C und D (Liu et al., 2020).
- Für den Menschen sind vor allem die Influenza-Viren A und B klinisch relevant (und werden daher hier weitergehend beschrieben). Die Auswirkungen einer Infektion mit Influenza-Viren Typ C sind in der Regel harmlos, können aber bei Kindern unter 2 Jahren bei Infektionen der unteren Atemwege zu Komplikationen führen. Der 2018 neu entdeckte Typ D befällt hauptsächlich Rinder und springt dabei meist auf andere Tiere wie Ziege und Schafe über. Generell wird davon ausgegangen, dass der Mensch bisher keine Immunität gegenüber diesem Typen besitzt, es ist jedoch auch bisher noch nicht allzu viel über die Auswirkungen auf die menschliche Gesundheit bekannt (Liu et al., 2020).
- Der Influenza-Typ A weist mehrere Subtypen auf, die sich durch die Hämagglutinin- (H) und Neuraminidase- (N) Proteine auf der Membran unterscheiden und entsprechend benannt werden. Es sind 18 verschiedene Hämagglutinin-Subtypen (H1-18) und 11 verschiedene Neuraminidase-Subtypen (N1-11) bekannt. (Boktor & Hafner, 2023).
 Abbildung 1: Influenza-Virus A/California/7/2009 (H1N1), koloriert, Negativkontrastierung im Transmissionselektronenmikroskop (TEM) Primärvergrößerung x 85000 (Robert Koch-Institut, 2017).
Abbildung 1: Influenza-Virus A/California/7/2009 (H1N1), koloriert, Negativkontrastierung im Transmissionselektronenmikroskop (TEM) Primärvergrößerung x 85000 (Robert Koch-Institut, 2017).- Aufgrund des segmentierten Genoms sind Influenza-Viren in der Lage dazu, der Immunität ihres Wirtes über Mutation und Reassortierung bzw. Antigenverschiebungen zu entkommen (s. Abb. 2), wodurch stets ein gewisses Risiko der Entstehung pandemischer Virusstämme existiert – dies gilt insbesondere für den Typen A, der immer wieder die Artengrenze (Übertragung z. B. von Vögeln oder Schweinen auf den Menschen) durchbricht (Vijaykrishna et al., 2015; Robert Koch-Institut, 2016).
Abbildung 2: A) Schematische Darstellung des Prinzips der Reassortierung mit zwei dreiteiligen Genomen („Eltern“), die eine neue, diskordante Reassortante hervorbringen. Tritt ausschließlich bei RNA-Viren wie den Influenza-Viren auf, die eine Zelle koinfizieren. Die dunkleren Farben stellen die Elternstämme dar, die helleren Farben den reassortierten Stamm. In Anlehnung an Vijaykrishna et al., 2015.
Infektionsmodus
- Die Übertragung erfolgt primär durch Tröpfchen mit einer Größe von > 5μm, aber auch über Aerosole (< 5μm), direkten Kontakt mit infizierten Personen oder kontaminierten Gegenständen (Kumar, 2017; Robert Koch-Institut, 2018; Leung, 2021).
- Die Inkubationszeit ist im Vergleich zu anderen Viren mit durchschnittlich 1 bis 2 Tagen (Spannweite 1 bis 4 Tage) sowohl bei Kindern als auch Erwachsenen recht kurz (Kumar, 2017; Kalarikkal & Jaishankar, 2023).
- Die Ausscheidung von Viren ist theoretisch schon vor Symptombeginn, in der präsymptomatischen Phase möglich, die vorhandene Evidenz dazu ist jedoch laut einem systematischen Review sehr limitiert. Die Übertragung in der präsymptomatischen Phase wurde aus dem Vorhandensein von Influenza-Viren in den oberen Atemwegen abgeleitet und nicht aus Übertragungs-Experimenten (Patrozou & Mermel, 2009).
- Die ausgeschiedene Menge an Viren und damit auch das Infektionsrisiko ist höher, wenn die Symptome einer Influenza-Erkrankung stärker ausgeprägt sind. Die gemittelte Ausscheidungsdauer wird mit 5 bis 7 Tagen angenommen. Menschen mit Immundefizienz, aber auch Menschen mit Vorerkrankungen, wie z. B. Übergewicht, scheinen Influenza-Viren länger auszuscheiden (Leekha et al., 2007; Maier et al., 2018; Robert Koch-Institut, 2023b).
- Die sekundäre Befallsrate (SAR) im Haushalt beträgt 1,4 bis 38, die Basis-Reproduktionszahl (R0) 1,0 bis 21,0 (Leung, 2021).
Infektionsverlauf
- Es gibt in der Literatur unterschiedliche Angaben über den Anteil asymptomatischer Influenza-Fälle. Die Flu-Watch-Kohortenstudie, die auch das ECDC zitiert, ergab einen Anteil von 75 % asymptomatischen Fällen in der Kohorte – das heißt 25 % PCR-bestätigte, klinisch relevante Erkrankungen an allen serologisch identifizierten Infektionen (Hayward et al., 2014). Es gibt jedoch auch Schätzungen, nach denen nur jeder Dritte (ca. 33,3 %) Infizierte keine Symptome entwickelt. Als Faustregel gibt das RKI an: Ein Drittel erkrankt mit Symptomen, ein Drittel entwickelt eine milde Erkältungskrankheit und ein Drittel entwickelt keine Symptome (Patrozou & Mermel, 2009; European Centre for Disease Prevention and Control, 2017; Robert Koch-Institut, 2018).
- Durch die kurze Inkubationszeit kommt es bei den Menschen, die Symptome entwickeln, zu einem plötzlichen Auftreten der Erkrankung – dies kann Fiebergefühl, Schüttelfrost, Kopfschmerzen, schwerer Myalgie, Unwohlsein und/oder Anorexie umfassen. Zusätzlich können auch Husten, Nasensekrete, Halsschmerzen und – abhängig vom Subtyp – Augensymptome wie Photophobieauftreten. Die Schwere der Erkrankung wird durch Fieber, Kopfschmerzen und Myalgie bestimmt (Moghadami, 2017; Boktor & Hafner, 2023).
- Die von trockenem Husten und Unwohlsein geprägte Rekonvaleszenzphase kann einige Wochen andauern (Moghadami, 2017). Leistungs- und/oder Schul-Sport sollten für diese Zeit gemieden werden, um herzbedingte Komplikationen zu reduzieren.
Komplikationen
- Das Robert Koch-Institut bezeichnet schwere Influenza-Verläufe insgesamt als „selten“ (Robert Koch-Institut, 2018).
- Meist haben Patienten mit einem schwereren Verlauf zu Beginn der Erkrankung hohes Fieber, das schon am zweiten oder dritten Tag wieder sinkt – eine Fieberdauer von bis zu 8 Tagen ist allerdings auch möglich (Moghadami, 2017). Die Progression tritt oft 3 bis 10 Tage nach Symptombeginn auf (Robert Koch-Institut, 2018).
- Ein schwerer Verlauf kann entweder durch die Influenza-Viren selbst oder durch eine bakterielle Koinfektion bzw. Superinfektion (z. B. Streptokokken oder Staphylokokken) bedingt sein (European Centre for Disease Prevention and Control, 2017). Als Folge kommt es meist zur viralen (etwa 70 % der Fälle auf der Intensivstation) oder bakteriellen (etwa 20 % der schweren Verläufe) Pneumonie(European Centre for Disease Prevention and Control, 2017; Sarda et al., 2019).
- Bei Kindern kommt es eher zu Mittelohrentzündungen, ganz selten werden auch beatmungspflichtige Erkrankungen wie Myokarditis und Enzephalopathie beobachtet (Robert Koch-Institut, 2018).
Mögliche, aber auch seltene Auswirkungen einer Influenza-Infektion umfassen:
- Kardiale Komplikationen (Arrhythmie, Herzischämie, Kardiomyopathie, koronare Herzkrankheit, Endokarditis, Myokarditis, Myokardinfarkt, Perikarditis, pulmonale Herzkrankheit etc.)
- Neurologische Komplikationen (Post-Influenza-Enzephalitis, Guillain-Barré-Syndrom, Reye-Syndrom, Parkinson-Symptome, Narkolepsie etc.)
- Muskuloskelettale Komplikationen (z. B. Myopathie, Myositis)
- Augenmanifestationen (Bindehautentzündung, akute Retinitis etc.)
- Nierenkomplikationen (akute Nierenschädigung (AKI), akute Glomerulonephritis, Minimal-Change-Glomerulonephritis und akute tubulointerstitielle Nephritis (ATIN) etc.)
- Hepatische Komplikationen (z. B. Hepatits, Lebererkrankungen)
- Hämatologische Komplikationen (Thromboembolische Erkrankungen, hämolytisch-urämisches Syndrom (HUS), Hämophagozytose-Syndrom (HPS) etc.)
- Endokrine Komplikationen (z. B. bei Diabetikern diabetische Ketoazidose (DKA))
Die Qualität der Literatur zu Komplikationen einer Influenza-Erkrankung ist insgesamt als limitiert zu bewerten, da meist nur Fallberichte, Fallserien und Beobachtungsstudien zu dem Thema existieren. Zudem besteht ein Verzerrungsrisiko, da ein Großteil der Literatur zu Influenza von der Schweinegrippe-Pandemie (2009) kommt (Sellers et al., 2017).
Bisher wenig erforscht sind mögliche langfristige Folgen, die dem Long-COVID- bzw. Post-COVID-Syndrom ähneln:
- Langfristige Folgen einer nicht persistenten Virus-Erkrankung, wie etwa Influenza, werden schon recht lange beschrieben und hatten dementsprechend bei Fachautoren in der Vergangenheit viele Namen: Myalgische Enzephalomyelitis, epidemische Neuromyasthenie, Akureyri-Krankheit, Island-Krankheit und Royal-Free-Krankheit. Inzwischen wird der Terminus Postvirales Syndrom genutzt (Archer, 1987).
- Trotzdem sind bisher kaum Beobachtungsstudien zum Postviralen-Syndrom bei Influenza oder anderen Viren wie beispielsweise dem Epstein-Barr-Virus oder dem Adenovirus (mit Ausnahme von COVID-19) vorhanden, sondern meist nur Fallberichte oder -serien und Literaturreviews. Das tatsächliche Ausmaß an langfristigen Folgen einer Influenza-Infektion ist somit sehr schwer einschätzbar. Die Notwendigkeit der Forschung wurde erst durch COVID-19 aufgezeigt und steckt somit noch in den Kinderschuhen (Hirschenberger et al., 2021).
- Als Symptome werden in der Literatur bisher v. a. Depressionen und Ermüdungserscheinungen bzw. ME/CFS beschrieben (Burrell et al., 2017; Collins et al., 2021; Choutka et al., 2022).
- Die Erkenntnisse in der Forschung um COVID-19 nützen vereinzelt aber auch zum Verständnis von Influenza-Infektionen: Eine australische Kohortenstudie, in welcher Patienten mit positivem PCR-Test für eine Influenza- oder COVID-19-Infektion 12 Wochen lang nachbegleitet wurden, konnte keinen statistisch signifikanten Unterschied bezüglich der Schwere oder Häufigkeit der Symptome festgestellen. Das postvirale Syndrom scheint sich nach diesen Ergebnissen bei einer Influenza- oder COVID-19-Infektion nicht zu unterscheiden (Brown et al., 2023).
- Zum Postviralen Syndrom bei COVID-19 (Long-COVID bzw. Post-COVID) lesen Sie bitte hier weiter.
Abbildung 3: Flussdiagramm zur Darstellung des Infektionsverlaufes, der Prognose sowie möglicher Folgen einer Influenza-Infektion, eigene Darstellung.
Pathogenese
Die Pathogenese wird in zwei Phasen eingeteilt:
- Die erste Phase dauert 1 bis 3 Tage und zeigt das Ausmaß der mit der Virusreplikation verbundenen Entzündung auf.
- Abhängig davon folgt in der zweiten Phase entweder die Kontrolle des Virus durch das Immunsystem oder die Ausbreitung mit der Folge einer schweren bis tödlichen Erkrankung.
(Gounder & Boon, 2019)
Als Virulenzfaktoren gelten die für den Influenza-Subtyp charakteristischen Membranproteine:
- Hämagglutinin, welches an den Epithelzellen im Respirationstrakt (v. a. Luftröhren und Bronchien) haftet und so das Fortschreiten der Infektion ermöglicht
- Neuraminidase, das zur Verbreitung der Virionen beiträgt
(Boktor & Hafner, 2023)
Bei der Pathogenese sind sowohl die angeborene als auch die adaptive Immunität von Bedeutung:
- Die Viruselimination sowie der Schutz vor einer erneuten Infektion hängen von der adaptiven Immunität (Bildung einer wirksamen T- und B-Zellenantwort, insbesondere CD8, sowie neutralisierenden Antikörperreaktion) ab (Gounder & Boon, 2019; Hartshorn, 2020).
- Die angeborene Immunität spielt eine Rolle bei der Reaktionsgeschwindigkeit und Informationsvermittlung der adaptiven Immunität, außerdem beeinflusst sie die Reaktion auf Impfstoffe (Hartshorn, 2020).
- Als erste Verteidigungslinie werden lösliche Faktoren im Respirationstrakt, respiratorischen Epithel und den in der Lunge ansässigen Immunzellen (Alveolarmakrophagen) aufgefasst. Dieser Teil der angeborenen Immunität ist wichtig, um die Virusreplikation und mögliche Entzündungsschäden zu begrenzen (Hartshorn, 2020).
- Laut CDC wurde bisher nur selten eine Influenza-Virämie dokumentiert (Centers for Disease Control and Prevention, 2021).
Prävention
- Vielfach wird die Impfung als bester oder auch kosteneffizientester Schutz vor einer schweren Influenza-Erkrankung oder-Infektion bezeichnet (European Centre for Disease Prevention and Control, 2017; Moghadami, 2017; Neumann et al., 2018; Robert Koch-Institut, 2018; Barranco & Chahine, 2020; Chen et al., 2021). Dazu mehr unter Influenza: Die Impfung.
Weitere Schutzmaßnahmen umfassen:
- Gründliches Händewaschen (40 bis 60 Sekunden) mit Wasser und Seife
- Alternativ oder ergänzend: Händedesinfektionsmittel auf Alkoholbasis
- Bedecken von Mund und Nase beim Niesen oder Husten
- Selbstisolation bei ersten Symptomen wie Fieber und Husten bzw. Vermeidung von engem Kontakt mit Erkrankten (auch im Haushalt)
- Zudem empfiehlt das ECDC das korrekte Tragen von Gesichtsmasken während der Influenza-Saison in geschlossenen, öffentlichen Räumen und sollte auch in überfüllten Außenbereichen in Betracht gezogen werden, insbesondere bei gefährdeten Personengruppen. Laut ECDC gibt es für diese Maßnahme seit der COVID-19-Pandamie gute Evidenz, da Influenza-Viren demselben Übertragungsweg wie SARS-CoV-2 folgt – Literatur wird zu dieser Aussage jedoch nicht angefügt. Ein Anfang 2023 erschienenes systematisches Review von Cochrane, in dem 12 Studien (davon 10 Cluster-RCTs) eingeschlossen wurden, kam demgegenüber zu dem Ergebnis:
„Das Tragen von [medizinischen/chirurgischen] Masken in der Bevölkerung hat wahrscheinlich keinen oder nur einen geringen Einfluss auf das Auftreten von grippeähnlichen Erkrankungen (ILI)/COVID-19-ähnlichen Erkrankungen im Vergleich zum Nichttragen von Masken (moderate Evidenz). Das Tragen von Masken in der Gemeinschaft hat wahrscheinlich keinen oder nur einen geringen Einfluss auf das Ergebnis bei laborbestätigter Influenza/SARS-CoV-2 im Vergleich zum Nichttragen von Masken (moderate Evidenz)“ (Übersetzung des Verfassers) (Jefferson et al., 2023).
Prognose
- Der Schweregrad bzw. die Komplikationsraten wie Krankenhausaufenthalte und Todesfälle, aber auch die Dauer und die betroffenen Altersgruppen variieren teils erheblich in den verschiedenen Saisons. Bei Dominanz von A(H3N2)-Viren wird ein höherer Anteil an schweren Verläufen angenommen, vor allem bei Kindern und älteren Menschen (Boktor & Hafner, 2023).
- Influenza-Stämme, die die unteren Atemwege infizieren, verursachen mehr Entzündungen sowie schwere Komplikationen (Dharmapalan, 2020).
- Das Risiko an Influenza zu versterben, steigt mit dem Alter und der Anzahl an Komorbiditäten immer weiter an (Cohen et al., 2023; Dattani & Spooner, 2022).
 Abbildung 4: Das Risiko, an einer Atemwegserkrankung zu sterben, steigt mit dem Alter an. Kleinkinder und ältere Menschen haben ein erhöhtes Sterberisiko (Dattani & Spooner, 2022).
Abbildung 4: Das Risiko, an einer Atemwegserkrankung zu sterben, steigt mit dem Alter an. Kleinkinder und ältere Menschen haben ein erhöhtes Sterberisiko (Dattani & Spooner, 2022).Das ECDC listet folgende chronische Erkrankungen unabhängig vom Alter als Risikofaktoren für einen schweren Verlauf auf (European Centre for Disease Prevention and Control, 2017):
- Stoffwechselkrankheiten (z. B. Diabetes);
- Chronische Lungenerkrankungen (z. B. chronische Bronchitis);
- Herz-Kreislauf-Erkrankungen (z. B. koronare Herzkrankheit);
- Lebererkrankungen;
- Hämatologische Erkrankungen;
- Adipositas (Body-Mass-Index >40);
- Genetische Bedingungen;
- Chronische Nierenerkrankungen (z. B. chronisches Nierenversagen);
- Chronische neurologische Erkrankungen oder körperliche Behinderungen (z. B. Zerebralparese);
- Erkrankungen und Behandlungen, die die Immunfunktion unterdrücken (z. B. Chemotherapie).
Zudem konnte auch bei
- gesunden, schwangeren Frauen und
- Asthmatikern
ein erhöhtes Risiko für eine Hospitalisierung festgestellt werden (Dodds et al., 2007; Coleman et al., 2018).
Nicht zuletzt gibt es auch einen Unterschied bei der Prognose einer Influenza-Erkrankung bei Menschen, die in einkommensschwächeren (LMICs) und einkommensstärkeren (HICs) Ländern leben:
- Das Risiko einer Influenza-bedingten Einweisung auf die Intensivstation ist in LMICs um das Siebenfache erhöht. Das Risiko mechanischer Beatmung und zu versterben ist jeweils um das Vierfache erhöht, dabei konnte jedoch keine statistische Signifikanz festgestellt werden (Cohen et al., 2023).
- Kinder in LMICs haben generell im Vergleich zu Kindern in HICs ein erhöhtes Risiko für einen schweren Verlauf (Coleman et al., 2018).
Auch wenn Schätzungen in LMICs tendentiell unpräziser sind, da z. B. weniger Influenza-Tests veranlasst sowie Sterbefälle erfasst werden (Dattani & Spooner, 2022), gibt es Hinweise darauf, warum das Risiko für schwere Influenza-Fälle hier höher ist: Dies könnte unter anderem durch die begrenzte Gesundheitsinfrastruktur und Gesundheitsversorgung (z. B. Impfungen, antivirale Medikamente), höhere Raten an Begleiterkrankungen (z. B. HIV) und geringere Hygiene-Standards aufgrund von niedrigerem sozioökonomischem Status zu erklären sein (W. A. Fischer et al., 2014; Hadakshi et al., 2020).
Zeitgleich mit der Verbesserung der hygienischen Bedingungen, dem sozioökonomischen Status und dem Zugang sowie der Qualität der Gesundheitsversorgung in LICs hat sich das relative Risiko, zu versterben, seit dem 20. Jahrhundert immer weiter verringert (s. Abb. 5).
 Abbildung 5: Menschen, die erst vor kurzem geboren wurden, haben ein geringeres Risiko, an Grippe zu sterben. In dieser Studie wurden historische Daten aus den Vereinigten Staaten verwendet, um zu zeigen, dass Menschen, die in jüngerer Zeit geboren wurden, ein viel geringeres Risiko haben, an einer Grippe zu sterben, selbst wenn sie gleich alt sind (Dattani & Spooner, 2022).
Abbildung 5: Menschen, die erst vor kurzem geboren wurden, haben ein geringeres Risiko, an Grippe zu sterben. In dieser Studie wurden historische Daten aus den Vereinigten Staaten verwendet, um zu zeigen, dass Menschen, die in jüngerer Zeit geboren wurden, ein viel geringeres Risiko haben, an einer Grippe zu sterben, selbst wenn sie gleich alt sind (Dattani & Spooner, 2022).
Therapie
Hierbei muss zwischen Risikogruppen und Nicht-Risikogruppen unterschieden werden:
- Personen, die nicht zur Risikogruppe gehören und bei denen kein Verdacht auf Komplikationen besteht, können v. a. symptomatisch (z. B. viel Flüssigkeit oral, ggf. über Infusionen, Fieberbegleitung und ggf. Fiebersenkung) behandelt werden.
- Personen, die zur Risikogruppe gehören und bei denen ein Verdacht auf Komplikationen besteht, können v. a. antiviral behandelt werden. Eine antivirale Therapie sollte innerhalb von 48 Stunden nach Auftreten der ersten Symptome erfolgen.
- Ein labordiagnostischer Nachweis kann sinnvoll sein, sollte die Behandlung jedoch nicht verzögern.
- Standardmäßig werden die Neuraminidase-Hemmer Oseltamivir und Zanamivir eingesetzt, um die Freisetzung neugebildeter Influenza-A- und Influenza-B-Viren zu unterdrücken. Resistenzen sind bisher selten, aber möglich und werden von europäischen Public-Health-Behörden überwacht. Nebenwirkungen vom oralen Oseltamivir sind Übelkeit und Erbrechen, beim inhalativen Zanamivir können bei Asthmatikern Anfälle auftreten.
- Das nur gegen Influenza-A-Viren wirkende Amantadin wird aufgrund zunehmender Resistenzen und schlechterer Verträglichkeit nicht mehr verwendet.
- Bei einer bakteriellen Superinfektion sind an das jeweilige Keimspektrum angepasste Antibiotika indiziert.
(European Centre for Disease Prevention and Control, 2017; Robert Koch-Institut, 2018)
Epidemiologie
Weltweite Zahlen und Daten:
- Seit dem frühen 20. Jahrhundert haben sich vier Influenza-Pandemien ereignet: 1918/19 durch Subtyp A(H1N1), 1957/59 durch A(H2N2), 1968 – 1970 durch A(H3N2) und 2009/10 durch A(H1N1)pdm09. Das Robert-Koch-Institut konstatiert, dass die Datenlage zu den bisherigen pandemiebedingten Todesfällen „zum Teil sehr lückenhaft“ ist. Zur Vorbereitung auf zukünftige Influenza-Pandemien wurde der aus zwei Teilen bestehende (Teil 1: Strukturen und Maßnahmen, Teil 2: Wissenschaftliche Grundlagen) Nationale Pandemieplan von Bund und Ländern sowie dem RKI erarbeitet (Robert Koch-Institut, 2016).
- Durch Hochrechnungen wird davon ausgegangen, dass Influenza-Epidemien der Typen A und B jährlich etwa 3 bis 5 Millionen schwere Fälle weltweit verursachen, wovon laut WHO 290.000 bis 650.000 Menschen versterben (Kalarikkal & Jaishankar, 2023; World Health Organization, 2023).
- Bis zu 20 % der Weltbevölkerung infizieren sich jährlich mit Influenza-Viren (Sellers et al., 2017).
- Seit der Schweinegrippe-Pandemie 2009 zirkulieren primär die beiden Influenza-Stämme A(H1N1) und A(H3N2), bei Influenza B die Linien Yamagata und Victoria (Gavigan & McCullers, 2019). Seit Beginn der COVID-19-Pandemie im Jahr 2020 wurde kein einziger Influenza-Fall mehr beobachtet, der durch den Yamagata-Stamm ausgelöst wurde (Deutsches Ärzteblatt, 2024; Monto et al., 2024).
- Durch die Maßnahmen während der COVID-19-Pandemie kam es zu einer Immunitätslücke bei Influenza-Viren, durch die anschließend, in der Saison 2022/2023, Menschen früher und häufiger erkrankten (Mahase, 2023).
Zahlen und Daten zu Kindern:
Abbildung 6: Kindersterblichkeitsrate nach Ursache, Deutschland (Our World in Data, 2019).
- Es wird davon ausgegangen, dass die meisten schweren Influenza-Fälle (inklusive Hospitalisierung, Intensivstation und Tod) in den ersten zwei Lebensjahren bei Kindern auftreten (Principi & Esposito, 2016).
- 99 % aller Influenza-Todesfälle bei Kindern treten in Entwicklungsländern auf (Belizaire et al., 2022).
- In einer belgischen Studie, in der retrospektiv Daten der nationalen SARI-Überwachung ausgewertet wurden, konnte festgestellt werden, dass Kinder ein 32 % höheres Risiko für einen schweren Infektionsverlauf hatten, wenn sie nicht mit Influenza infiziert waren, sondern mit anderen Atemwegsviren. Häufig wird lediglich das klinische Bild zur Diagnostik von Influenza genutzt. Da Rhinoviren, RS-Viren, humane Metapneumoviren oder Mykoplasmen häufig ein ähnliches Krankheitsbild hervorrufen, könnte die wahre Krankheitslast von Influenza ohne Multi-Virus-Tests unter- oder überschätzt werden (Robert Koch-Institut, 2018; N. Fischer et al., 2023).
Zahlen und Daten zur Situation in Deutschland:
- Von 2005 bis 2008 wurden in Deutschland insgesamt nur 20 pädiatrische, schwere Influenza-Fälle gemeldet – die Inzidenz schwerer Influenza-Fälle in PICUs bezeichneten die Autoren daher als „relativ niedrig“. Dies sei jedoch womöglich auch bedingt durch die moderate Influenza-Aktivität während dieser drei Saisons (Streng et al., 2011).
- An der jährlich entstehenden Grippe- bzw. Erkältungswelle sind nicht nur Influenza-Viren beteiligt, sondern auch andere Viren wie hCoV, Rhinoviren oder PIV. (s. Abb. 7 und 8).
 Abbildung 7: Nachweisraten für Influenzaviren, hCoV, SARS-CoV-2, RSV, hMPV, PIV und Rhinoviren (Positivenraten; rechte y-Achse) an allen im Rahmen des Sentinels eingesandten Proben (linke y-Achse, graue Balken) von der 40. KW 2022 bis zur 38. KW 2023 (Robert Koch-Institut, 2023c).
Abbildung 7: Nachweisraten für Influenzaviren, hCoV, SARS-CoV-2, RSV, hMPV, PIV und Rhinoviren (Positivenraten; rechte y-Achse) an allen im Rahmen des Sentinels eingesandten Proben (linke y-Achse, graue Balken) von der 40. KW 2022 bis zur 38. KW 2023 (Robert Koch-Institut, 2023c). Abbildung 8: Nachweisraten für Influenzaviren, hCoV, SARS-CoV-2, RSV, hMPV, PIV, Adenoviren und Rhinoviren (Positivenraten; rechte y-Achse) an allen im Rahmen des Sentinels eingesandten Proben (linke y-Achse, graue Balken) von der 40. KW 2023 bis zur 15. KW 2024 (Robert Koch-Institut, 2024).
Abbildung 8: Nachweisraten für Influenzaviren, hCoV, SARS-CoV-2, RSV, hMPV, PIV, Adenoviren und Rhinoviren (Positivenraten; rechte y-Achse) an allen im Rahmen des Sentinels eingesandten Proben (linke y-Achse, graue Balken) von der 40. KW 2023 bis zur 15. KW 2024 (Robert Koch-Institut, 2024).- In Deutschland werden laut Schätzungen der Arbeitsgemeinschaft Influenza (AGI) des RKI etwa 1 bis 7 Millionen Arztbesuche aufgrund von Influenza verzeichnet. Eine schwere Grippewelle wie etwa in der Saison 2012/2013 könne bis zu 30.000 Krankenhauseinweisungen und 20.000 Todesfälle bedeuten, leichtere Grippewellen dagegen nur 3.000 Krankenhauseinweisungen, wodurch eine Influenza-assozierte Übersterblichkeit nicht nachzuweisen ist (Robert Koch-Institut, 2018).
- Diese Zahlen sind jedoch als statistische Hochrechnungen – anhand der Gesamtzahl der Todesfälle oder der als „Pneumonie oder Influenza“ kodierten Todesfälle – zu verstehen, da die genaue Zahl der Todesfälle für Influenza nicht bekannt ist. Bei der Schätzung muss beachtet werden, dass bei Todesfällen häufig nicht auf Influenza-Viren untersucht wird, diese nicht nachweisbar sind oder andere Faktoren (wie Herz-Kreislauf-Erkrankungen) als Todesursache angegeben wurden (Robert Koch-Institut, 2023b).
- Die Influenza-Saison 2017/2018 in Deutschland gilt als die schwerste seit 30 Jahren. In einer retrospektiven Multicenter-Kohortenstudie mit 1.560 Patienten wurde die krankenhausbezogene Fallsterblichkeit auf 6,7 % und auf der Intensivstation auf 22,4 % geschätzt. An das RKI wurden 1.674 laborbestätigte Todesfälle gemeldet – das RKI geht jedoch von etwa 25.100 Todesfällen für die gesamte Grippesaison aus (Robert Koch-Institut, 2019; Rößler et al., 2021).
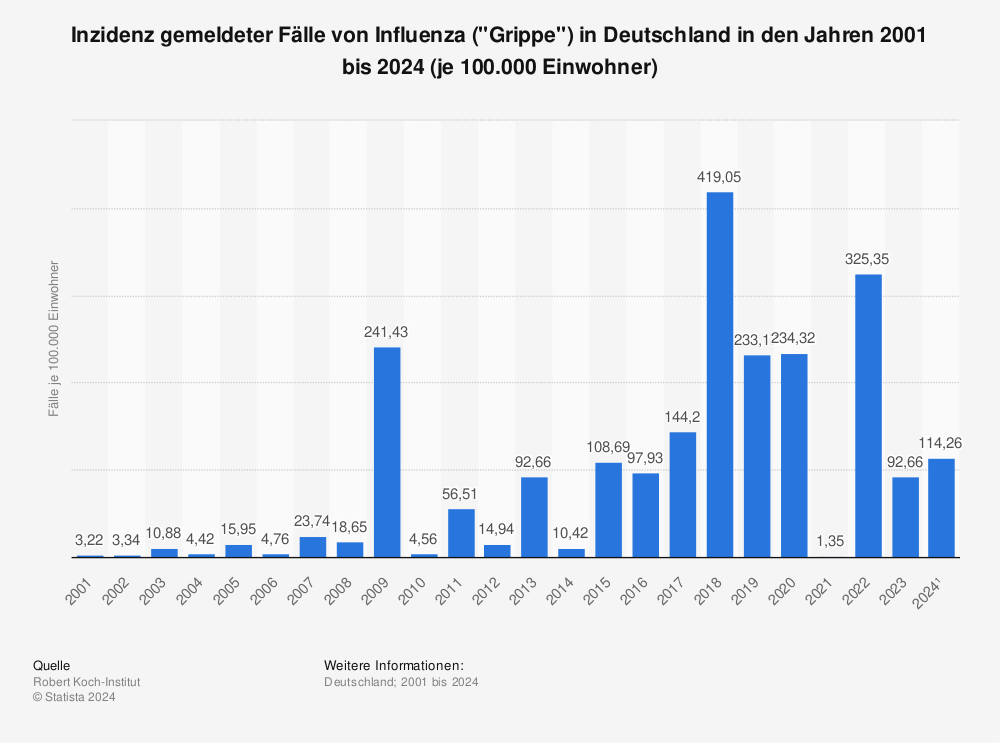
- Die Inzidenz pro 100.000 Einwohner in Deutschland liegt schätzungsweise seit 2001 jährlich zwischen 1,34 und 419,05 (Radtke, 2024a), wobei das Auftreten von Influenza-Viren durch die in den Corona-Pandemie-Jahren ergiffenen non-pharmakologischen Maßnahmen beeinflusst wurde. Konnten 2021 fast gar keine Influenza-Viren nachgewiesen werden, folgte 2022 nach einer starken RSV-Welle dann eine recht frühe und starke Influenza-Welle, die ihren Höhepunkt schon Mitte Dezember erreichte (Radtke, 2024b; Robert Koch-Institut, 2023b).
Abbildung 9: Inzidenz gemeldeter Fälle von Influenza („Grippe“) in Deutschland in den Jahren 2001 bis 2023 (Radtke, 2024a).
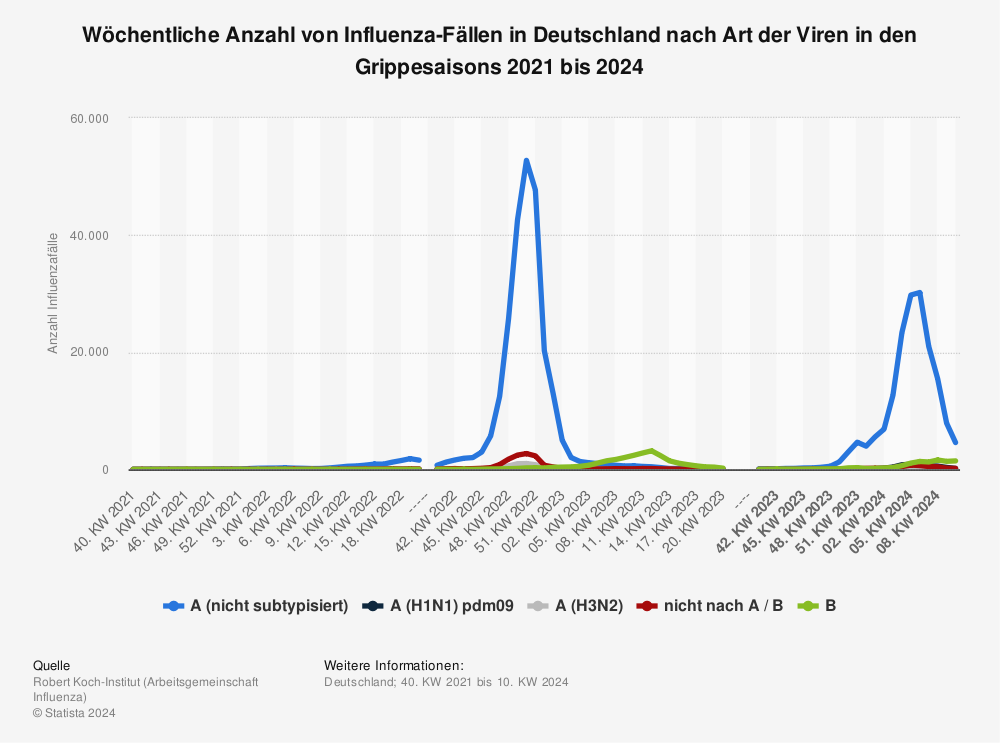
Abbildung 10: Wöchtentliche Anzahl von Influenza-Fällen in Deutschland nach Art der Viren in den Grippe-Saisons 2021 bis 2023 (Radtke, 2024b).
- Zum Jahreswechsel 2022/2023 machten saisonal bedingt die Influenza-Viren den größten Anteil der SARI-Fälle (mit über 30 %) aus – Mitte/Ende Januar 2023 lag die Aktivität nur noch im einstelligen Prozentbereich.
- Bis zur 50. KW 2023 (18.-24. September 2023) wurden Influenza-Infektionen nur vereinzelt nachgewiesen – den größten Anteil an allen SARI-Fällen (severe acute respiratory infections bzw. schwere akute Atemwegsinfektionen) machte hier COVID-19 aus. Ab der 50. KW 2023 stieg der Anteil der Influenza-Fälle im selben Maße, wie die COVID-19-Fälle sanken. Seit der 6. KW 2024 ist die Anzahl der Influenza-Fälle sowie die Gesamtzahl der neu im Krankenhaus aufgenommenen SARI-Fälle rückläufig. Die Welle an Influenza-Infektionen erreichte ein ähnliches, teilweise höheres Niveau wie die Welle an COVID-19-Infektionen, war jedoch von kürzerer Dauer (Robert Koch-Institut, 2024).
- Die Gesamtzahl der bisher an das RKI übermittelten, labordiagnostisch bestätigten Influenza-Fälle bis zur 15. Meldewoche der Saison 2023/2024 beträgt 208.248. Davon wurden 43.135 Fälle hospitalisiert. Die Anzahl der Todesfälle in der Saison liegt bei 972, wovon 89 % zur Altersgruppe ab 60 Jahren gehören, 9 % zur Altersgruppe 35 bis 59 Jahre (Robert Koch-Institut, 2024).
- Nach der Definition des RKI endete die Grippewelle nach 15 Wochen mit der 12. Kalenderwoche 2024 (Robert Koch-Institut, 2024).
 Abbildung 11: Wöchentliche Anzahl der neu im Krankenhaus aufgenommenen SARI-Fälle (graue Balken, linke y-Achse) sowie Anteil der Fälle mit einer zusätzlichen COVID-19-Diagnose, einer RSV-Diagnose bzw. einer Influenza-Diagnose unter den SARI-Fällen (farbige Linien, rechte y-Achse). Die Daten stammen aus 70 Sentinel-Kliniken von der 40. KW 2022 bis zur 15. KW 2024 – für die letzten Wochen ist noch mit weiteren Änderungen in den Fallzahlen zu rechnen (Robert Koch-Institut, 2024).Influenza: Die Impfung
Abbildung 11: Wöchentliche Anzahl der neu im Krankenhaus aufgenommenen SARI-Fälle (graue Balken, linke y-Achse) sowie Anteil der Fälle mit einer zusätzlichen COVID-19-Diagnose, einer RSV-Diagnose bzw. einer Influenza-Diagnose unter den SARI-Fällen (farbige Linien, rechte y-Achse). Die Daten stammen aus 70 Sentinel-Kliniken von der 40. KW 2022 bis zur 15. KW 2024 – für die letzten Wochen ist noch mit weiteren Änderungen in den Fallzahlen zu rechnen (Robert Koch-Institut, 2024).Influenza: Die ImpfungZugelassene Impfstoffe
- In Deutschland stehen in der Saison 2023/2024 von den insgesamt 10 zugelassenen Impfstoffen 9 aktualisierte, tetravalente Impfstoffe zum Schutz gegen Influenza zur Verfügung (s. Tabelle 1).
- Bis zur Saison 2012/2013 gab es ausschließlich trivalente saisonale Impfstoffe. Seit 2017 empfiehlt die STIKO eine Impfung mit einem quadrivalenten Impfstoff nach aktueller WHO-empfohlener Antigenkombination (Deutsches Grünes Kreuz e. V., 2017).
- Bei allen in Deutschland zugelassenen Influenza-Impfstoffen handelt es sich um Totimpfstoffe. Es kann auch bei geimpften Personen zu einer Infektion kommen – die Impfstoffe sollen primär vor Erkrankung und Tod schützen (Robert Koch-Institut, 2023a).
Name
Art des Impfstoffs
Zugelassen ab (Alter)
Stamm-Update 2023/2024
Afluria Tetra
Spaltimpfstoff, inaktiviert
18 Jahren
Ja
Efluelda
Spaltimpfstoff, inaktiviert, Hochdosis
60 Jahren
Ja
Fluad Tetra
Untereinheiten-Impfstoff aus Oberflächenantigen, inaktiviert
65 Jahren
Ja
Flucelvax Tetra
Untereinheiten-Impfstoff aus Oberflächenantigen, inaktiviert
2 Jahren
Ja
Fluenz Tetra
Virusimpfstoff, lebend-attenuiert, nasal
2-17 Jahren
Ja
Infusplit Tetra
Virusimpfstoff, inaktiviert
6 Monaten
Ja
Influvac Tetra
Virusimpfstoff, inaktiviert
6 Monaten
Ja
Supemtek
rekombinant
18 Jahren
Nein
Vaxigrip Tetra
Spaltimpfstoff, inaktiviert
6 Monaten
Ja
Xanaflu Tetra
Untereinheiten-Impfstoff aus Oberflächenantigen, inaktiviert
6 Monaten
Ja
Tabelle 1: In Deutschland zugelassene Impfstoffe gegen Influenza (Paul-Ehrlich-Institut, 2023)
Hintergrund
- Durch die hohe antigenetische Variabilität von Influenza-Viren kommt es zur Zirkulation unterschiedlicher Subtypen in jeder Grippesaison. Die WHO gibt jährlich für die nördliche Hemisphäre eine Empfehlung zur Zusammensetzung von Grippeimpfstoffen für die Hersteller ab. Die Empfehlung stellt eine Schätzung dar, die auf Beobachtungen der Zirkulation Influenza-Viren in der südlichen Hemisphäre basiert. Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittel-Agentur (EMA) (in Zusammenarbeit mit dem Paul-Ehrlich-Institut) überprüft die Empfehlungen der WHO und macht sie damit für die EU rechtlich bindend (Paul-Ehrlich-Institut, 2023).
- Da es sich dabei eben nur um Prognosen handelt, können die Vorhersagen auch nicht zutreffen und es so zu einem „mismatch“ (einer fehlenden Übereinstimmung) zwischen Antigen im Impfstoff und den tatsächlich zirkulierenden Virussubtypen kommen. Dies hat großen Einfluss auf die Impfeffektivität, wie auch das RKI zu bedenken gibt (Robert Koch-Institut, 2023a).
- Bei Influenza-B-Viren wird in bis zu zwei Dritteln (ca. 66,6 %) der in Studien ausgewerteten Saisons ein solcher mismatch festgestellt (Heikkinen et al., 2014; Puzelli et al., 2019; da Costa et al., 2022). Nicht nur bei Influenza B, sondern auch bei Influenza A sprechen Forscher mittlerweile von einer „unvorhersagbaren Natur“ der Viren sowie der Impfeffektivität (Dos Santos et al., 2015; Zanobini et al., 2022).
- Durch das Verschwinden des Influenza-B-Stammes Yamagata 2020 haben sich Experten im New England Journal of Medicine und die WHO dafür ausgesprochen, bei den Impfstoffen für die Saison 2024/2025 auf die 4. Komponente, die inaktivierte Form von Yamagata, zu verzichten, da dessen Nutzung nicht nur absolet ist, sondern das Risiko besteht, dass die bei der Impfstoffherstellung verwendeten attenuierten Viren wieder in den Wildtyp mutieren. Es obliegt den jeweiligen Behörden, ob vom tetravalenten Impfstoff wieder auf den trivalenten Impfstoff umgestiegen werden soll (Deutsches Ärzteblatt, 2024; Monto et al., 2024; World Health Organization, 2024).
Wirksamkeit:
Ältere Menschen:
- Grundsätzlich ist von einer gewissen Wirksamkeit der vorhandenen tetravalenten Impfstoffe bei >60 Jährigen auszugehen – selbst wenn die Antigene im Impfstoff nicht zu den in der Saison zirkulierenden Virusstämmen passen (Tricco et al., 2013; Carregaro et al., 2023). Es bleibt jedoch fraglich, wie unterschiedlich der Schutzeffekt bei „match“ oder „mismatch“ ist, ob die Impfeffektivität signifikant ist, nicht überschätzt wird und die Impfstoffe ein positives Nutzen-Risiko-Profil aufweisen.
- In einer kanadischen, prospektiven und bevölkerungsbasierten Überwachung der Influenza-bedingten Hospitalisierungen über 7 Saisons konnte festgestellt werden, dass 33 % der Patienten im Alter von 50 bis 64 den aktuellen Grippeimpfstoff erhalten hatten. Zu 40% der Krankenhauseinweisungen kam es aufgrund von Influenza A(H3N2), zu 30% aufgrund von A/H1N1 und zu 22% aufgrund von Influenza B. Über 86 % der Patienten hatten mindestens eine Grunderkrankung (Kim et al., 2023).
- Ein 2018 veröffentlichtes systematisches Cochrane-Review untersuchte sehr umfassend die vorhandene Evidenz zu Wirksamkeit und potentiellen Nebenwirkungen der Grippeschutzimpfung bei älteren Menschen. Die Studienautoren schlussfolgerten, dass der Effekt trivalenter inaktivierter Influenzaimpfstoffe bei älteren Menschen aus RCTs, die ein geringes Bias-Risiko aufweisen, „bescheiden“ sei, unabhängig von Setting, Ergebnis, Population und Studiendesign. Das Risiko Influenza-ähnlicher Beschwerden (ILI) würde laut der Meta-Analyse von 6 % auf 3,5 % sinken (Impfeffektivität [VE] 41%). Über die Auswirkungen der Impfstoffe auf das Risiko, wegen Influenza hospitalisiert zu werden, Lungenentzündung zu erleiden oder zu versterben, lagen zu wenig Informationen vor. Die Evidenz aus Beobachtungsstudien (Nicht-RCT-Evidenz) würde wiederum keine zufriedenstellende Antwort liefern, da sie stark interpretationsbedürftig sei und ein hohes Biasrisiko bestehen könnte. Dass zukünftig mehr qualitative Evidenz folgt, sei jedoch leider nicht zu erwarten, da RCTs mittlerweile als ethisch nicht mehr vertretbar angesehen werden (Demicheli, Jefferson, Pietrantonj, et al., 2018).
- Zu einem ähnlichen Ergebnis wie die Cochrane-Autoren kamen auch weitere Forscher, die ein aktualisiertes systematisches Review mit prospektiver Meta-Analyse nach PRISMA-Richtlinien durchführten und 2024 veröffentlichten: Während Beobachtungsstudien auf einen stärkeren Schutzeffekt der Influenza-Impfung hindeuten und mit einer niedrigeren Gesamtmortalität, Hospitalisierung wegen kardiovaskulärer Erkrankungen und allen Gründen (all-cause-hospitalization) verbunden waren, deuten randomisierte kontrollierte Studien nur auf eine Verringerung des Risikos für eine Hospitalisierung wegen kardiovaskulärer Erkrankungen durch die Impfung hin (Liu et al., 2024).
- In einem systematischen Review mit Meta-Analyse von 2024, in welchem sich die Autoren die Evidenz aus Test-Negativ-Design-Studien angeschaut haben, wird der Schutzeffekt gegen eine laborbestätigte Influenza-Infektion und damit verbundenen Krankenhausaufenthalten wie in der Cochrane-Studie als „bescheiden“ (moderate) angegeben. Die gepoolte Impfeffektivität gegen jede Art von Influenza wurde mit 41,4 % angegeben und lag je nach Stamm und Alter der geimpften Gruppe höher oder niedriger (Guo et al., 2024).
- Laut arznei-telegramm sei die häufige Annahme, dass Influenza-Impfungen die Gesamtmortalität um bis zu 50 % senken können, unrealistisch, da Beobachtungsstudien auch auf einen Nutzen außerhalb der Impfsaison hinweisen. Dies sei ein Hinweis auf den healthy-user-effect (bei COVID-19 als Healthy Vaccinee Bias bezeichnet) (arznei-telegramm, 2008).
- Insbesondere für rekombinante Influenza-Impfstoffe (z. B. Supemtek®) sei die Evidenz für Wirksamkeit und Effektivität bei über 50 Jährigen derzeit begrenzt, folgert ein Mai 2023 veröffentlichtes systematisches Review (O Murchu et al., 2023b).
- Ein 2012 veröffentlichtes systematisches Review mit Meta-Analyse über die in den USA zugelassenen Influenza-Impfstoffe kommt zu dem Ergebnis, dass es keine Belege für einen Schutzeffekt bei Erwachsenen über 65 Jahren gibt. Es wurden Artikel einbezogen, die zwischen 1967 und 2011 veröffentlicht wurden (Osterholm et al., 2012).
- Eine groß angelegte japanische Registerstudie mit Daten von über 83.000 über 65-Jährigen zwischen 2014 und 2020 konnte nicht nur keine signifikante Schutzwirkung durch die Influenza-Impfung vor Hospitalisierung feststellen, auch wurde eine Trend der Abschwächung („trend of gradual attenuation“) der Impfeffektivität beobachtet. Die Forscher konstatieren: „Ärzte sollten auch bei geimpften Personen eine Influenza-Infektion vermuten“ (Uemura et al., 2023).
- Eine 2024 veröffentlichte italienische, Test-Negativ-Fall-Kontroll-Studie mit Daten von Influenza-Geimpften aus den Saisons 2018/2019 bis 2022/2023 ergab einen wöchentlichen, signifikanten Verlust der Impfeffektivität gegen A(H3N3) um 5 bis 7 % bei der Impfung von Kindern und älteren Erwachsenen. Die modulierte Impfeffektivät betrug bereits nach 14 Wochen 0 %. Deswegen sprechen die Autoren von einer „suboptimalen“ Impfeffektivität am Ende der Saison gegen einen der dominantesten Stämme A(H3N2) und bekräftigen die Notwendigkeit neuer Impfstoffe mit längerer Schutzwirkung. Bei den B-Stämmen wurde die Impfeffektivität von 0 % erst zwischen Woche 22 und 23 (also am Ende der Influenza-Saison) erreicht, bei A(H1N1) blieb sie relativ konstant ≥ 45 % (Domnich et al., 2024). Weitere Studien bestätigen diesen starken Verlust an Impfeffektivität für A(H3N2) und die B-Stämme (Kissling et al., 2016).
- Bei den unterschiedlichen Fluad®-Impfstoffen (MF59® adjuvantierte trivalente Impfstoffe, nicht-adjuvantierte trivalente oder quadrivalente Impfstoffe) des Herstellers Seqirus konnte in einem 2023 erschienen systematischen Review kein signifikanter Unterschied in der relativen Impfeffektivität bei Über-65-Jährigen festgestellt werden. Zudem wiesen Impfstoffe mit dem Adjuvans MF59® mehr lokale unerwünschte Nebenwirkungen und systemische Reaktionen auf (O Murchu et al., 2023a).
- Eine höhere Dosis des Influenza-Impfstoffes bei Über-65-Jährigen wirkt laut einem systematischen Review, das die vorhandene Evidenz aus RCTs ausgewertet hat, besser als die Standarddosis (Wilkinson et al., 2017).
Schwangere:
- Die WHO sieht – ähnlich wie die STIKO – eine hohe Priorität bei der Impfung Schwangerer, da diese ein erhöhtes Risiko für einen schweren Verlauf mit Influenza-Viren aufweisen. Jedoch stammt die Evidenz zur Wirksamkeit und Sicherheit der Impfung bei Schwangeren aus Beobachtungsstudien, welche keine Kausalität herstellen können und eine Wahrscheinlichkeit aufweisen, dem „healthy-vaccinee bias“ zu unterliegen. In einem systematischen Cochrane-Review wurde nur ein RCT mit einem geringen Bias-Risiko ermittelt, dessen Ergebnisse in Bezug auf Verringerung von Todesfällen und Krankenhausaufenthalten bei Schwangeren durch die Impfung jedoch unklar waren. Die Number Needed to Vaccine (NNV) betrug 55 bei einem erhöhten Risiko von Nebenwirkungen. Dementsprechend kamen die Cochrane-Autoren zu dem Ergebnis, dass von inaktivierten Influenza-Impfstoffen ein sehr unsicherer oder begrenzter Schutz gegen Influenza-like Illness (ILI) zu erwarten ist. Weitere RCTs seien dringend notwendig (Demicheli, Jefferson, Ferroni, et al., 2018; Donzelli, 2018).
Kinder:
- Ein systematisches Cochrane-Review zur Influenza-Impfung bei gesunden Kindern findet im Vergleich zum Placebo eine anteilige Reduktion von laborbestätigten Influenza-Infektionen durch attenuierte Lebendimpfstoffe um 14 % (mäßige Sicherheit), bei ILI um 5 % (geringe Sicherheit). Somit müssten 7 Kinder geimpft werden, damit 1 sich nicht infiziert und 20 geimpft werden, damit 1 nicht erkrankt. Ähnlich sieht es auch bei (Mittel-)Ohrentzündungen aus. Allerdings wurden keine Daten zur Verringerung von Krankenhausaufenthalten gesichtet. Bei inaktivierten Impfstoffen entspricht die Reduktion 19 % (bei Infektionen, hohe Sicherheit) sowie 8 % (bei ILI, mittlere Sicherheit). Hier müssten jeweils 5 bzw. 12 Kinder geimpft werden, um 1 Infektion bzw. Erkrankung zu verhindern. Bei Mittelohrentzündungen sei keine Reduktion zu erwarten. Die Nebenwirkungen seien in den ausgewerten Studien jedoch nicht gut beschrieben worden (Jefferson et al., 2018), was eine Nutzen-Risiko-Analyse schwierig gestalten dürfte.
- Eine maternale Influenza-Impfung scheint keinen Einfluss auf das Risiko der Hospitalisierung oder des Todes während der ersten 6 Lebensmonate von Kindern zu haben – die Autoren einer Fall-Kontroll-Studie, in der Daten von über 400.000 Lebendgeburten ausgewertet wurden, konnten bei Säuglingen, deren Mütter geimpft wurden, keinen Unterschied gegenüber der Kontrollgruppe feststellen (Sukumaran et al., 2018).
- Zu einem ähnlichen Ergebnis kam auch eine retrospektive Kohortenstudie, in der Daten von über 100.000 Lebendgeburten ausgewertet wurden, zur maternalen H1N1-Influenza-Impfung: Es wurde kein Zusammenhang zur pädiatrischen Gesundheit innerhalb der ersten fünf Lebensjahre entdeckt (Walsh et al., 2019).
Medizinisches Personal:
- Ein systematisches Cochrane-Review, das vier Cluster-RCTs (7.558 Teilnehmer) und eine Kohortenstudie (12.742 Teilnehmer) identifizieren konnte, fand keinen Effekt der Impfung von Beschäftigten im Gesundheitswesen zur Reduzierung der Infektionen oder Komplikationen (inkl. Hospitalisierungen und Tod) bei Bewohnern (< 60 Jahre) in Langzeitpflegeeinrichtungen (Thomas et al., 2013).
Nebenwirkungen
Hinweis: Um die Tabelle vollständig anzuzeigen, scrollen Sie bitte mit Maus oder Touchpad nach rechts und links.
Häufigkeit
Sehr häufig (>1/10)
Häufig
(≥ 1/100 bis < 1/10)
Gelegentlich (≥ 1/1.000 bis < 1/100)
Selten
(≥ 1/10.000, < 1/1.000)
Post-Marketing-Surveillance / Nicht bekannt
Afluria® Tetra
(Studienteilnehmer ab 18 Jahren)
Kopfschmerzen (v. a. Ältere), Myalgie, Schmerzen an der Injektionsstelle
Übelkeit, Erbrechen, Fieber (beides gelegentlich bei Älteren), Unwohlsein, Schwellung/Induration und Rötung an der Injektionsstelle,
Schüttelfrost,
Infektion der oberen Atemwege, Schwindelgefühl, Halsschmerzen, Husten, laufende Nase, verstopfte
Nase, Durchfall, Ermüdung, Jucken an der Injektionsstelle
Allergische Reaktion, Muskel-, Gelenk- und Knochenschmerzen, Hautreaktionen wie Quaddeln, Vaskulitis, Neuralgie, Parästhesie, Konvulsionen, neurologische Erkrankungen wie Verwirrtheit oder Verlust von Reflexen, (Prä-)Synkope, verminderte Anzahl an roten Blutkörperchen, ILI
Efluelda®
(Studienteilnehmer ab 60 Jahren)
Schmerzen an der Injektionsstelle, Erythem an der Injektionsstelle, Unwohlsein, Myalgie, Kopfschmerzen
Schwellung / Verhärtung / blauer Fleck an der Injektionsstelle, Fieber (≥ 37,5 Grad Celsius), Schüttelfrost
Jucken an der Injektionsstelle, Ermüdung, Muskelschwäche, Lethargie, Husten, Schmerzen im Oropharynx, Diarrhö, Erbrechen, Übelkeit, Dyspepsie
Asthenie, Arthralgie, Schmerz in den Extremitäten, Schwindelgefühl, Parästhesie, Rhinorrhö, Pruritus, Urtikaria, nächtliche Schweißausbrüche, Ausschlag, Flush, Vertigo, Augenhyperämie
Brustkorbschmerz, Guillain-Barré-Syndrom, Konvulsionen, Fieberkrämpfe, Myelitis, Fazialislähmung, Optikusneuritis, Brachial-Neuritis, Synkope (unmittelbar nach der Impfung), Thrombozytopenie, Lymphadenopathie, Atemnot, Giemen, Engegefühl im Hals, Anaphylaxie, allergische und Überempfindlichkeits- Reaktionen, Vaskulitis, Vasodilatation
Fluad® Tetra
(Studienteilnehmer ab 65 Jahren)
Kopfschmerzen, Schmerzen an der Injektionsstelle, Ermüdung
Appetitverlust, Übelkeit, Diarrhöe, Myalgie, Arthralgie, Ekchymosen oder blaue Flecken an der Injektionsstelle, Schüttelfrost, Erythem, Induration, ILI
Fieber (≥ 38 Grad Celsius), Erbrechen
Thrombozytopenie, Lymphadenopathie, ausgeprägte Schwellungen (> 1 Woche)/Cellulitis-ähnliche Reaktionen an der Injektionsstelle, Asthenie, Unwohlsein, Fieber, Anaphylaxie, Muskelschwäche, Schmerz in einer Extremität, Enzephalomyelitis, Guillain-Barré-Syndrom, Krämpfe, Neuritis, Neuralgie, Parästhesie, Synkope, Präsynkope, Generalisierte Hautreaktionen (z. B. Erythema multiforme, Urtikaria, Pruritus oder unspezifischer Ausschlag), Angioödem, Vaskulitis auch mit Nierenbeteiligung
Flucelvax® Tetra
(Studienteilnehmer ab 18 Jahren)
Schmerzen an der Injektionsstelle (34%), Kopfschmerzen (14%), Ermüdung (14%), Myalgie(14%), Erythem (13%) und Induration (10%).
Appetitverlust, Übelkeit, Diarrhöe, Erbrechen, Arthralgie, Ekchymosen, Schüttelfrost
Fieber (≥ 38 Grad Celsius)
Allergische oder unmittelbare Überempfindlich- keitsreaktionen, einschließlich anaphylaktischer Schock, Parästhesie, Guillain-Barré-Syndrom, Generalisierte Hautreaktionen, einschließlich Pruritus, Urtikaria oder unspezifisches Exanthem, Ausgeprägte Schwellungen an der geimpften Extremität
Fluenz® Tetra
(Studienteilnehmer ab 2 Jahren)
Verminderter Appetit, Verstopfung der Nase/Rhinorrhoe, Unwohlsein
Kopfschmerzen, Myalgie, Pyrexie
Überempfindlichkeitsreaktionen, Epistaxis, Hautausschlag,
Guillain-Barré-Syndrom, mitochondriale Enzephalomyopathie
Infusplit® Tetra
(Studienteilnehmer ab 6 Monaten)
Schmerzen / Rötung / Schwellung an der Injektionsstelle (15,6 % bis 40,9 %), Erschöpfung, Muskelschmerzen, Reizbarkeit/Aufgeregtheit, Appetitlosigkeit, Benommenheit
Magen-Darm-Symptome, Schweißausbruch, Gelenkschmerzen, Schüttelfrost, Verhärtung an der Injektionsstelle,
Hämatom / Juckreiz an der Injektionsstelle, Fieber (≥ 38,0 Grad Celsius), Hautausschlag
Vorübergehende Lymphadenopathie, Allergische Reaktionen (einschließlich anaphylaktische Reaktionen), Neuritis, akute disseminierte Enzephalomyelitis, Guillain-Barré-Syndrom*, Nesselsucht, Juckreiz, Erythem, Angioödem, ILI Unwohlsein
Influvac® Tetra
(Studienteilnehmer ab 6 Monaten)
Kopfschmerzen, Müdigkeit, Schmerzen / Rötung / Schwellung / Induration an der Injektionsstelle, Schläfrigkeit / Müdigkeit, Schwitzen, Übelkeit, Abdominalschmerz, Durchfall, Erbrechen, Reizbarkeit/Zerfahrenheit, Myalgie, Fieber, Unwohlsein
Arthralgie, Schüttelfrost, Ekchymose
vorübergehende Thrombozytopenie, vorübergehende Lymphadenopathie, Allergische Reaktionen, die in seltenen Fällen auch zum Schock führen, Angioödem, Neuralgie, Parästhesie, fiebrige Krämpfe, neurologische Störungen wie Enzephalomyelitis, Neuritis und Guillain Barré Syndrom, Vaskulitis in sehr seltenen Fällen mit einer vorübergehenden renalen Beteiligung, Allgemeine Hautreaktionen einschließlich Pruritus, Urticaria oder unspezifischer Hautausschlag
Supemtek®
(Studienteilnehmer ab 18 Jahren)
Kopfschmerzen, Ermüdung, Myalgie, Arthralgie, Lokaler Druckschmerz, lokaler Schmerz
Übelkeit, Induration
/Schwellung,
Rötung, Fieber,
Frösteln/Schüttelfrost
Husten, Schmerzen im Oropharynx, Diarrhö, Pruritus, Dermatitis, Ausschlag Influenza-ähnliche Symptome, Jucken an der Injektionsstelle
Schwindelgefühl, Urtikaria
Hypersensitivität und anaphylaktische Reaktion, neurologische Erkrankungen, die z. B. zu Nackensteife, Paralyse, Gleichgewichtsverlust, Verwirrung oder Taubheit führen können (z. B. Guillain-Barré-Syndrom)
Vaxigrip® Tetra
(Studienteilnehmer ab 6 Monaten)
Kopfschmerzen, Myalgie, Unwohlsein, Schmerzen/Druck/Erythem an der Infektionsstelle, Erbrechen, Reizbarkeit, Appetitverlust, anomales Weinen, Unwohlsein, Fieber, Verschlafenheit
Schüttelfrost, Schwellung / Verhärtung / Ekchymose an der Injektionsstelle,
Lymphadenopathie, Schwindel, Hitzewallung, Übelkeit, Diarrhö, Fatigue, Wärme / Pruritus an der Injektionsstelle, Thrombozytopenie, Weinerlichkeit, Unruhe, Schmerzen im Oberbauch
Überempfindlichkeit, allergische Reaktionen wie Angioödem, allergische Dermatitis, generalisierter Pruritus, Urtikaria, Erythem, Parästhesie, Somnolenz, Dyspnoe, Arthralgie, Hyperhidrose, Asthenie, ILI, Beschwerden / Ausschlag an der Injektionsstelle, papulöser Hautausschlag,
Anaphylaktische Reaktionen, allergische einschließlich anaphylaktischer Reaktionen, Transiente Thrombozytopenie, Lymphadenopathie, Parästhesie, Guillain-Barré-Syndrom, Neuritis, Neuralgie, Konvulsionen, Enzephalomyelitis, Vaskulitis, wie beispielsweise Purpura Schönlein-Henoch, auch mit vorübergehender Nierenbeteiligung
Xanaflu® Tetra
Kopfschmerzen, Müdigkeit / Schläfrigkeit, Schwitzen, Appetitverlust, Durchfall, Erbrechen, Reizbarkeit/Zerfahrenheit, Fieber, Schmerzen / Rötung / Schwellung / Induation an der Injektionsstelle, Bauchschmerzen, allgemeines Unwohlsein
Myalgie, Arthralgie, Schüttelfrost, Ekchymose der Injektionsstelle, Zittern
Pruritus, Urtikaria, Hautausschlag, Entzündungen der Blutgefäße (Vaskulitis) die zu
Hautausschlag und in sehr seltenen Fällen zu vorübergehenden Nierenbeschwerden führen können, Neuralgie, Missempfindungen von Berührung,
Schmerzen, Wärme und Kälte (Parästhesie), Krampfanfälle (verbunden mit Fieber), neurologische Erkrankungen, die z. B. zu Nackensteife, Paralyse, Gleichgewichtsverlust, Verwirrung oder Taubheit führen können (Enzephalomyelitis, Neuritis und Guillain-
Barré-Syndrom), vorübergehende Verminderung der Blutplättchenzahl
(transiente Thrombozytopenie),
vorübergehende Schwellung der Lymphknoten
in Hals, Achselhöhlen oder Leisten (transiente
Lymphadenopathie)
Tabelle 2: Nebenwirkungen der in Deutschland zugelassenen, an die Saison 2023/2024 angepassten Influenza-Impfstoffe laut den Hersteller-Fachinformationen. Für die Differenzierung nach Altersgruppen s. Fachinformationen der Hersteller (AstraZeneca, 2023; GSK, 2023a, 2023b; Sanofi, 2023; Sanofi Pasteur, 2023a, 2023b; Seqirus, 2023a, 2023b, 2023c; Viatris Healthcare, 2023, 2023). * Bisher kein kausaler Zusammenhang bestätigt
Ältere Menschen:
- In einer retrospektiven Kohortenstudie mit Sentinel-Daten des britischen Hausärzteverbandes wurden die Nebenwirkungen (unerwünschte Ereignisse von Interesse, adverse events of interest [AEIs]) zell-basierter quadrivalenter Influenza-Impfstoffe (QIVc, in Deutschland nur Flucelvax®) mit Hühnerei-basierten Influenza-Impfstoffen (QIVe, alle anderen Impfstoffe enthalten geringe Mengen an Hühnereiweiß) in der Altersgruppe der 18 bis 64 und > 65 Jährigen verglichen. In der stratifiziertenAnalyse wurde bei beiden Altersgruppen eine um 16 % niedrigere Inzidenz bei den QIVe, aber auch bei den adjuvantierten trivalenten Influenza-Impfstoffen (aTIV) ermittelt (Lusignan et al., 2021).
- Im Vergleich zur Standard-Dosis konnte bei dem Hochdosis-Impfstoff eine höhere Frequenz an Schwellungen und Rötungen (lokale Reaktionen) nach der Impfung festgestellt werden (Smetana et al., 2017).
Schwangere & Kinder:
- Bezüglich unerwünschter Geburtsereignisse und Komplikationen während der Schwangerschaft und nach der Influenza-Impfung kommt ein neues, 2023 im BMJ veröffentlichtes systematisches Review, das 63 Beobachtungsstudien untersucht hat, zu dem Ergebnis: Die vorhandene Evidenz, dass die Influenza-Impfung sicher ist, ist nur von sehr geringer Qualität („very low certainty evidence“) (Wolfe et al., 2023).
- Ob Influenza-Impfstoffe vor Frühgeburtlichkeit und niedrigem Geburtsgewicht schützen oder ob sie das Risiko dafür sogar erhöhen, ist nach wie vor ungeklärt. Laut einem systematischen Review von Giles et al. (2018) ist von einem schützenden Effekt auszugehen. Ebenso wurde die Impfung nicht mit angeborenen Anomalien, spontanen Fehlgeburten oder Totgeburten in Verbindung gebracht (Giles et al., 2018).
- Allerdings kommt ein weiteres systematisches Review mit qualitativ hochwertiger, der Heterogenität der vorhandenen Studien entgegenwirkenden Bayes'scher Meta-Analyse (ebenso wie ein WHO-Bericht) zu einem anderen Ergebnis: Es konnte keine schützende Wirkung der Influenza-Impfung gegenüber nachteiligen Geburtsereignissen (aber auch keine Verbindung dazu) hergestellt werden. Es wurden 2 RCTs, 41 Kohortenstudien und 5 Fall-Kontroll-Studien einbezogen. Die Autoren konstatieren, dass es an methodisch robusten Studien fehle (Jeong et al., 2019).
- In einer retrospektiven Kohortenstudie mit Sentinel-Daten des britischen Hausärzteverbandes zur quadrivalenten Influenza-Impfung (QIV) in den Saisons 2010 bis 2018 konnte bei Schwangeren und Kindern unter 5 Jahren ein erhöhtes Auftreten unerwünschter Ereignisse von Interesse (AEIs) im Vergleich zur trivalenten Influenza-Impfung (TIV) festgestellt werden. Die AEIs variierten dabei je nach Impfstoff und Saison: 2014/2015 traten vor allem Hautausschlag und muskuloskelettale Erkrankungen auf, 2016/2017 vor allem Atemwegserkrankungen. Insgesamt wurde eine erhöhte relative Inzidenz von 1,78 (95%CI, 1,62-1,95) bei Schwangeren und 1,76 (95%CI, 1,56 - 1,99) bei Kindern unter 5 Jahren ermittelt. Eine relative Inzidenz < 1 hätte eine geringere Inzidenz an AEIs im Vergleich zur TIV bedeutet. Die Autoren folgern, dass routinemäßig erhobene Sentinel-Daten eine konsistente Methode darstellen könnten, das Nutzen-Risikoprofil der Impfstoffe zu evaluieren. Die Qualität der Daten sei jedoch trotzdem als limitiert zu betrachten, da möglicherweise nicht alle AEIs in der medizinischen Grundversorgung (z. B. an Hausärztinnen und -ärzte) gemeldet werden (Cross et al., 2020).
- In einem Phase-3-RCT wird das Sicherheitsprofil des für Kinder zugelassenen zell-basierten quadrivalenten Impfstoffes als „tolerierbar“ bewertet (Eun et al., 2019).
Sonstiges:
- Hersteller von Grippeimpfstoffen arbeiten bereits an mRNA-Alternativen zu den herkömmlichen Influenza-Impfstoffen. Da die zugelassenen, herkömmlichen Influenza-Impfstoffe kaum Schutz gegen pandemische Stämme bieten, wird versucht einen Nukleosid-modifizierten Boten-RNA (mRNA)-Lipid-Nanopartikel-Impfstoff zu entwickeln, der alle bekannten Influena-A-Subtypen und Influenza B-Linien abdeckt. Erste Erfolge wurden anhand von Studien mit Mäusen und Frettchen verzeichnet (Arevalo et al., 2022).
- Mittlerweile befinden sich einige mRNA-Grippeimpfstoffe in Phase-3-Studien, wie z. B. der Moderna-Kombinationsimpfstoff gegen COVID-19 und Influenza mRNA-1083 (Hohmann-Jeddi, 2024).
- Eine durch die EU-Kommission unterstützte italienische Public-Health-Studie (FLURESP) zum Nutzen und Vergleich von zehn verschiedenen Maßnahmen bei pandemischen Erregern (wie Influenza oder SARS-CoV-2) kam zu dem Ergebnis, dass Screening-Maßnahmen und Massenimpfungen die am wenigsten kostenwirksamen Maßnahmen bei der Verringerung der Sterblichkeit waren. Das beste Kosten-Nutzen-Verhältnis wiesen die Verringerung von Sekundärinfektionen und die Implementierung von lebenserhaltenden Geräten auf der Intensivstation auf (Beresniak et al., 2023).
Influenza: Die STIKO-EmpfehlungenDie Empfehlungen
Empfohlen wird eine saisonale Impfung:
- Personen, die 60 Jahre oder älter sind bzw. auch Personen, die in Alters- oder Pflegeheimen leben
- Personen, die Grunderkrankungen aufweisen, auch Kinder ab dem 6. Lebensmonat (Risikofaktoren: s. Influenza: Die Erkrankung)
- Personen, die als Infektionsquelle ein Risiko für andere im Haushalt lebende Personen darstellen (z. B. Pfleger)
- Personen, die ein beruflich erhöhtes Risiko aufweisen (z. B. medizinisches Personal)
- Schwangeren, die sich im 2. Trimenon befinden; oder bei erhöhtem Risiko durch eine Grunderkrankung: Schwangeren, die sich im 1. Trimenon befinden
Dabei ist laut STIKO zu beachten:
- Gegen COVID-19 und Influenza kann simultan geimpft werden, jedoch soll die Injektion der Impfstoffe in unterschiedliche Gliedmaße erfolgen. Anm. ÄFI: Erste Studien dazu deuten auf eine etwas erhöhte Wahrscheinlichkeit systemischer Reaktionen (Reaktogenität) hin, wenn gleichzeitig ein COVID-19-mRNA-Impfstoff und Grippeimpfstoff verimpft werden. Diese Ergebnisse könnten jedoch stark durch Störfaktoren (Confounder) beeinflusst sein (Hause et al., 2022).
- Die Impfung soll im Spätherbst (Mitte Oktober bis Mitte Dezember) einmalig verabreicht werden.
- Präferiert werden soll ein „quadrivalenter Impfstoff mit aktueller von der WHO empfohlener Antigenkombination“.
- Für Personen ab 60 Jahren gibt es aufgrund der reduzierten Immunantwort im Alter (Immunseneszenz) einen „Hochdosis-Impfstoff“, der jedoch auch mit mehr lokalen Nebenwirkungen (Schmerzen, Rötung, Schwellung) einhergeht.
(Robert Koch-Institut, 2023a)
Kritik an den STIKO-Empfehlungen
- Die Impf-Empfehlungen werden auch anhand statistischer Hochrechnungen über mögliche Influenza-Todesfälle abgeleitet. Die Methodik ist dabei nicht als evidenz-basiert anzusehen, da hier nicht auf medizinisches Erfahrungswissen gesetzt wird, sondern trotz unzähliger unbekannter Faktoren eine mehr oder weniger genaue Schätzung abgegeben wird.
- Auch wenn bestimmte Personengruppen ein höheres Risiko für einen schweren Influenza-Verlauf aufweisen, haben wir es bei der „echten Grippe“ doch mit einer insgesamt milden Erkrankung zu tun, die seltenst schwer verläuft. Die vorhandene Evidenz zu Influenza-Impfstoffen ist – insbesondere was die Vermeidung von Hospitalisierung und Tod angeht – mehr als dürftig (kaum RCTs vorhanden, die Evidenz aus Beobachtungsstudien ist stark interpretationsbedürftig und anfällig für Verzerrungen).
- Die Impfstoffeffektivität gegen A(H3N2) verringert sich schon innerhalb der Saison, in der geimpft wird, stark. Studien deuten darauf hin, dass bei einer anfänglichen Impfeffektivität von etwa 47 % nach nur 14 bis 15 Wochen kein Schutzeffekt mehr vorhanden ist (Kissling et al., 2016; Domnich et al., 2024). Da bei Dominanz von A(H3N2) ein höherer Anteil von schweren Verläufen angenommen wird, ist dies einmal mehr kritisch. Bei einer Verabreichung der Influenza-Impfung ab Mitte Oktober bedeutet dies eine Impfeffektivität von 0 % ab Mitte Januar. Gerade bei Influenza-Viren ist jedoch davon auszugehen, dass der Höhepunkt in Deutschland erst zum Jahreswechsel bzw. Beginn des neuen Jahres auftritt. Auch bei den Influenza-B-Stämmen ist ein deutlicher, wenn auch nicht so starker Verlust des Impfschutzes innerhalb der Saison zu beobachten.
- Zudem muss geklärt werden, inwiefern die Schutzwirkung von sich jährlich wiederholenden, an die zirkulierende Variante angepasste Influenza-Impfungen abnimmt.
- Unklar bleibt auch das Sicherheitsprofil. Es ist wie bei anderen Impfstoffen davon auszugehen, dass es eine starke Untererfassung potentieller Nebenwirkungen gibt. Weitere, für Verzerrungen weniger anfällige Studien sind dringend notwendig.
- Insgesamt ist die Impfempfehlung für alle Personengruppen, denen die STIKO eine Impfung empfiehlt, mit der aktuellen Evidenzlage nicht in Einklang zu bringen.
LiteraturverzeichnisArcher, M. I. (1987). The post-viral syndrome: A review. The Journal of the Royal College of General Practitioners, 37(298), 212–214.
Arevalo, C. P., Bolton, M. J., Le Sage, V., Ye, N., Furey, C., Muramatsu, H., Alameh, M.-G., Pardi, N., Drapeau, E. M., Parkhouse, K., Garretson, T., Morris, J. S., Moncla, L. H., Tam, Y. K., Fan, S. H. Y., Lakdawala, S. S., Weissman, D., & Hensley, S. E. (2022). A multivalent nucleoside-modified mRNA vaccine against all known influenza virus subtypes. Science (New York, N.Y.), 378(6622), 899–904. https://doi.org/10.1126/science.abm0271
arznei-telegramm. (2008). Wird die Wirksamkeit der Influenzaimpfung überschätzt? arznei-telegramm.de. https://www.arznei-telegramm.de/html/2008_10/0810101_01.html
AstraZeneca. (2023). Fluenz Tetra Fachinformation. ema.europa.eu. https://www.ema.europa.eu/en/documents/product-information/fluenz-tetra-epar-product-information_de.pdf
Barranco, D., & Chahine, E. B. (2020). Adjuvanted inactivated influenza Vaccine Quadrivalent for Older People. The Senior Care Pharmacist, 35(9), 398–402. https://doi.org/10.4140/TCP.n.2020.398
Belizaire, M. R. D., N’gattia, A. K., Wassonguema, B., Simaleko, M. M., Nakoune, E., Rafaï, C., Lô, B., & Bolumar, F. (2022). Circulation and seasonality of influenza viruses in different transmission zones in Africa. BMC Infectious Diseases, 22(1), 820. https://doi.org/10.1186/s12879-022-07727-2
Beresniak, A., Napoli, C., Oxford, J., Daruich, A., Niddam, L., Duru, G., Tozzi, A. E., Atti, M. C. D., Dupont, D., Rizzo, C., & Bremond-Gignac, D. (2023). The FLURESP European commission project: Cost-effectiveness assessment of ten public health measures against influenza in Italy: is there an interest in COVID-19 pandemic? Cost Effectiveness and Resource Allocation: C/E, 21(1), 30. https://doi.org/10.1186/s12962-023-00432-0
Boktor, S. W., & Hafner, J. W. (2023). Influenza. In StatPearls. StatPearls Publishing. http://www.ncbi.nlm.nih.gov/books/NBK459363/
Brown, M., Gerrard, J., McKinlay, L., Marquess, J., Sparrow, T., & Andrews, R. (2023). Ongoing symptoms and functional impairment 12 weeks after testing positive to SARS-CoV-2 or influenza in Australia: An observational cohort study (S. 2023.04.16.23288205). medRxiv. https://doi.org/10.1101/2023.04.16.23288205
Burrell, C. J., Howard, C. R., & Murphy, F. A. (2017). Chapter 39—Viral Syndromes. In C. J. Burrell, C. R. Howard, & F. A. Murphy (Hrsg.), Fenner and White’s Medical Virology (Fifth Edition) (S. 537–556). Academic Press. https://doi.org/10.1016/B978-0-12-375156-0.00039-4
Carregaro, R. L., Roscani, A. N. C. P., Raimundo, A. C. S., Ferreira, L., Vanni, T., da Graça Salomão, M., Probst, L. F., & Viscondi, J. Y. K. (2023). Immunogenicity and safety of inactivated quadrivalent influenza vaccine compared with the trivalent vaccine for influenza infection: An overview of systematic reviews. BMC Infectious Diseases, 23(1), 563. https://doi.org/10.1186/s12879-023-08541-0
Centers for Disease Control and Prevention. (2021, September 18). Influenza. Pinkbook. https://www.cdc.gov/vaccines/pubs/pinkbook/flu.html
Chen, J., Wang, J., Zhang, J., & Ly, H. (2021). Advances in Development and Application of Influenza Vaccines. Frontiers in Immunology, 12, 711997. https://doi.org/10.3389/fimmu.2021.711997
Choutka, J., Jansari, V., Hornig, M., & Iwasaki, A. (2022). Unexplained post-acute infection syndromes. Nature Medicine, 28(5), Article 5. https://doi.org/10.1038/s41591-022-01810-6
Cohen, L. E., Hansen, C. L., Andrew, M. K., McNeil, S. A., Vanhems, P., Kyncl, J., Díez Domingo, J., Zhang, T., Dbaibo, G., Laguna-Torres, V. A., Draganescu, A., Baumeister, E., Gomez, D., Raboni, S. M., Giamberardino, H. I. G., Nunes, M. C., Burtseva, E., Sominina, A., Medić, S., … Chaves, S. S. (2023). Predictors of severity of influenza-related hospitalizations: Results from the Global Influenza Hospital Surveillance Network (GIHSN). The Journal of Infectious Diseases, jiad303. https://doi.org/10.1093/infdis/jiad303
Coleman, B. L., Fadel, S. A., Fitzpatrick, T., & Thomas, S.-M. (2018). Risk factors for serious outcomes associated with influenza illness in high- versus low- and middle-income countries: Systematic literature review and meta-analysis. Influenza and Other Respiratory Viruses, 12(1), 22–29. https://doi.org/10.1111/irv.12504
Collins, M. L., Cheney, G. A., Yehl, J. L., Sullivan, G. A., Stewart, J. T., & Catalano, G. (2021). Postviral Depression. Journal of Psychiatric Practice, 27(2), 126–130. https://doi.org/10.1097/PRA.0000000000000508
Cross, J. W., Joy, M., McGee, C., Akinyemi, O., Gatenby, P., & de Lusignan, S. (2020). Adverse events of interest vary by influenza vaccine type and brand: Sentinel network study of eight seasons (2010–2018). Vaccine, 38(22), 3869–3880. https://doi.org/10.1016/j.vaccine.2020.03.034
da Costa, J. C., Siqueira, M. M., Brown, D., Lopes, J. O., da Costa, B. C., Gama, E. L., & Aguiar-Oliveira, M. de L. (2022). Vaccine Mismatches, Viral Circulation, and Clinical Severity Patterns of Influenza B Victoria and Yamagata Infections in Brazil over the Decade 2010–2020: A Statistical and Phylogeny–Trait Analyses. Viruses, 14(7), 1477. https://doi.org/10.3390/v14071477
Dattani, S., & Spooner, F. (2022, Oktober 20). How many people die from the flu? Our World in Data. https://ourworldindata.org/influenza-deaths
Demicheli, V., Jefferson, T., Ferroni, E., Rivetti, A., & Pietrantonj, C. D. (2018). Vaccines for preventing influenza in healthy adults. Cochrane Database of Systematic Reviews, 2. https://doi.org/10.1002/14651858.CD001269.pub6
Demicheli, V., Jefferson, T., Pietrantonj, C. D., Ferroni, E., Thorning, S., Thomas, R. E., & Rivetti, A. (2018). Vaccines for preventing influenza in the elderly. Cochrane Database of Systematic Reviews, 2. https://doi.org/10.1002/14651858.CD004876.pub4
Deutsches Ärzteblatt. (2024, April 3). Influenza B/Yamagata seit COVID-19 verschwunden: WHO modifiziert vierte Komponente des Impfstoffs. aerzteblatt.de. https://www.aerzteblatt.de/nachrichten/149739/Influenza-B-Yamagata-seit-COVID-19-verschwunden-WHO-modifiziert-vierte-Komponente-des-Impfstoffs
Deutsches Grünes Kreuz e. V. (2017, Dezember). Grippe-Impfstoffe: Trivalent, tetravalent, adjuvantiert?Deutsches Grünes Kreuz für Gesundheit e.V. https://dgk.de/fachleute/dgk-fachnewsletter/grippe-impfstoffe-trivalent-tetravalent-adjuvantiert.html
Dharmapalan, D. (2020). Influenza. Indian Journal of Pediatrics, 87(10), 828–832. https://doi.org/10.1007/s12098-020-03214-1
Dodds, L., McNeil, S. A., Fell, D. B., Allen, V. M., Coombs, A., Scott, J., & MacDonald, N. (2007). Impact of influenza exposure on rates of hospital admissions and physician visits because of respiratory illness among pregnant women. CMAJ : Canadian Medical Association Journal, 176(4), 463–468. https://doi.org/10.1503/cmaj.061435
Domnich, A., Orsi, A., Signori, A., Chironna, M., Manini, I., Napoli, C., Rizzo, C., Panatto, D., & Icardi, G. (2024). Waning intra-season vaccine effectiveness against influenza A(H3N2) underlines the need for more durable protection. Expert Review of Vaccines, 23(1), 380–388. https://doi.org/10.1080/14760584.2024.2331073
Donzelli, A. (2018). Influenza Vaccinations for All Pregnant Women? Better Evidence Is Needed. International Journal of Environmental Research and Public Health, 15(9), 2034. https://doi.org/10.3390/ijerph15092034
Dos Santos, G., Neumeier, E., & Bekkat-Berkani, R. (2015). Influenza: Can we cope better with the unpredictable? Human Vaccines & Immunotherapeutics, 12(3), 699–708. https://doi.org/10.1080/21645515.2015.1086047
Eun, B. W., Lee, T. J., Lee, J., Kim, K. H., Kim, D. H., Jo, D. S., Shin, S. H., Kim, H., Kim, K.-H., & Kim, Y.-K. (2019). A Randomized, Double-blind, Active-controlled Phase III Trial of a Cell Culture-derived Quadrivalent Inactivated Influenza Vaccine in Healthy South Korean Children and Adolescents 6 Months to 18 Years of Age. The Pediatric Infectious Disease Journal, 38(9), e209–e215. https://doi.org/10.1097/INF.0000000000002406
European Centre for Disease Prevention and Control. (2017, Juni 14). Factsheet about seasonal influenza. Ecdc. https://www.ecdc.europa.eu/en/seasonal-influenza/facts/factsheet
Fischer, N., Moreels, S., Dauby, N., Reynders, M., Petit, E., Gérard, M., Lacor, P., Daelemans, S., Lissoir, B., Holemans, X., Magerman, K., Jouck, D., Bourgeois, M., Delaere, B., Quoilin, S., Gucht, S. V., Thomas, I., Bossuyt, N., & Barbezange, C. (2023). Influenza versus other respiratory viruses – assessing severity among hospitalised children, Belgium, 2011 to 2020. Eurosurveillance, 28(29), 2300056. https://doi.org/10.2807/1560-7917.ES.2023.28.29.2300056
Fischer, W. A., Gong, M., Bhagwanjee, S., & Sevransky, J. (2014). Global burden of Influenza: Contributions from Resource Limited and Low-Income Settings. Global heart, 9(3), 325–336. https://doi.org/10.1016/j.gheart.2014.08.004
Gavigan, P., & McCullers, J. A. (2019). Influenza: Annual seasonal severity. Current Opinion in Pediatrics, 31(1), 112–118. https://doi.org/10.1097/MOP.0000000000000712
Gounder, A. P., & Boon, A. C. M. (2019). Influenza Pathogenesis: The role of host factors on severity of disease. Journal of immunology (Baltimore, Md. : 1950), 202(2), 341–350. https://doi.org/10.4049/jimmunol.1801010
GSK. (2023a, Juni). Infusplit Tetra Fachinformation. gskpro.com. https://gskpro.com/content/dam/global/hcpportal/de_DE/produktinformationen/influsplit-tetra/FI_Influsplit%20Tetra_Injektionssuspension%20in%20Fertigspritze.pdf
GSK. (2023b, Juli). Fluarix Tetra Fachinformation. gsk-kompendium.at. https://www.gsk-kompendium.at/pil-fluarixtetra
Guo, J., Chen, X., Guo, Y., Liu, M., Li, P., Tao, Y., Liu, Z., Yang, Z., Zhan, S., & Sun, F. (2024). Real-world effectiveness of seasonal influenza vaccination and age as effect modifier: A systematic review, meta-analysis and meta-regression of test-negative design studies. Vaccine, 42(8), 1883–1891. https://doi.org/10.1016/j.vaccine.2024.02.059
Hadakshi, R. K., Patel, D. M., Patel, M. V., Patel, M. M., Patel, P. J., Patel, M. V., Yadav, K. S., Mahadeviya, H. J., Gajjar, R. A., Patel, P. N., & Patel, H. D. (2020). Association between socioeconomic status and influenza-like illness: A study from Western part of India. Journal of Family Medicine and Primary Care, 9(9), 4587–4591. https://doi.org/10.4103/jfmpc.jfmpc_856_19
Hartshorn, K. L. (2020). Innate Immunity and Influenza A Virus Pathogenesis: Lessons for COVID-19. Frontiers in Cellular and Infection Microbiology, 10, 563850. https://doi.org/10.3389/fcimb.2020.563850
Hause, A. M., Zhang, B., Yue, X., Marquez, P., Myers, T. R., Parker, C., Gee, J., Su, J., Shimabukuro, T. T., & Shay, D. K. (2022). Reactogenicity of Simultaneous COVID-19 mRNA Booster and Influenza Vaccination in the US. JAMA Network Open, 5(7), e2222241. https://doi.org/10.1001/jamanetworkopen.2022.22241
Hayward, A. C., Fragaszy, E. B., Bermingham, A., Wang, L., Copas, A., Edmunds, W. J., Ferguson, N., Goonetilleke, N., Harvey, G., Kovar, J., Lim, M. S. C., McMichael, A., Millett, E. R. C., Nguyen-Van-Tam, J. S., Nazareth, I., Pebody, R., Tabassum, F., Watson, J. M., Wurie, F. B., … Zambon, M. (2014). Comparative community burden and severity of seasonal and pandemic influenza: Results of the Flu Watch cohort study. The Lancet. Respiratory Medicine, 2(6), 445–454. https://doi.org/10.1016/S2213-2600(14)70034-7
Heikkinen, T., Ikonen, N., & Ziegler, T. (2014). Impact of influenza B lineage-level mismatch between trivalent seasonal influenza vaccines and circulating viruses, 1999-2012. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, 59(11), 1519–1524. https://doi.org/10.1093/cid/ciu664
Hirschenberger, M., Hunszinger, V., & Sparrer, K. M. J. (2021). Implications of Innate Immunity in Post-Acute Sequelae of Non-Persistent Viral Infections. Cells, 10(8), 2134. https://doi.org/10.3390/cells10082134
Hohmann-Jeddi, C. (2024, März 26). Moderna-Studie: Nächster Covid-19-Impfstoff mit drei Vorteilen. Pharmazeutische Zeitung. https://www.pharmazeutische-zeitung.de/naechster-covid-19-impfstoff-mit-drei-vorteilen-146432/
Jefferson, T., Dooley, L., Ferroni, E., Al-Ansary, L. A., Driel, M. L. van, Bawazeer, G. A., Jones, M. A., Hoffmann, T. C., Clark, J., Beller, E. M., Glasziou, P. P., & Conly, J. M. (2023). Physical interventions to interrupt or reduce the spread of respiratory viruses. Cochrane Database of Systematic Reviews, 1. https://doi.org/10.1002/14651858.CD006207.pub6
Jefferson, T., Rivetti, A., Pietrantonj, C. D., & Demicheli, V. (2018). Vaccines for preventing influenza in healthy children. Cochrane Database of Systematic Reviews, 2. https://doi.org/10.1002/14651858.CD004879.pub5
Jeong, S., Jang, E. J., Jo, J., & Jang, S. (2019). Effects of maternal influenza vaccination on adverse birth outcomes: A systematic review and Bayesian meta-analysis. PLoS ONE, 14(8), e0220910. https://doi.org/10.1371/journal.pone.0220910
Kalarikkal, S. M., & Jaishankar, G. B. (2023). Influenza Vaccine. In StatPearls. StatPearls Publishing. http://www.ncbi.nlm.nih.gov/books/NBK537197/
Kim, P., Coleman, B., Kwong, J. C., Plevneshi, A., Hassan, K., Green, K., McNeil, S. A., Armstrong, I., Gold, W. L., Gubbay, J., Katz, K., Kuster, S. P., Lovinsky, R., Matukas, L., Ostrowska, K., Richardson, D., & McGeer, A. (2023). Burden of Severe Illness Associated With Laboratory-Confirmed Influenza in Adults Aged 50-64 Years, 2010-2011 to 2016-2017. Open Forum Infectious Diseases, 10(1), ofac664. https://doi.org/10.1093/ofid/ofac664
Kissling, E., Nunes, B., Robertson, C., Valenciano, M., Reuss, A., Larrauri, A., Cohen, J. M., Oroszi, B., Rizzo, C., Machado, A., Pitigoi, D., Domegan, L., Paradowska-Stankiewicz, I., Buchholz, U., Gherasim, A., Daviaud, I., Horváth, J. K., Bella, A., Lupulescu, E., O Donnell, J., … I-MOVE case–control study team (2016). I-MOVE multicentre case-control study 2010/11 to 2014/15: Is there within-season waning of influenza type/subtype vaccine effectiveness with increasing time since vaccination?. Euro surveillance : bulletin Europeen sur les maladies transmissibles = European communicable disease bulletin, 21(16), 10.2807/1560-7917.ES.2016.21.16.30201. https://doi.org/10.2807/1560-7917.ES.2016.21.16.30201
Kumar, V. (2017). Influenza in Children. Indian Journal of Pediatrics, 84(2), 139–143. https://doi.org/10.1007/s12098-016-2232-x
Leekha, S., Zitterkopf, N. L., Espy, M. J., Smith, T. F., Thompson, R. L., & Sampathkumar, P. (2007). Duration of influenza A virus shedding in hospitalized patients and implications for infection control. Infection Control and Hospital Epidemiology, 28(9), 1071–1076. https://doi.org/10.1086/520101
Leung, N. H. L. (2021). Transmissibility and transmission of respiratory viruses. Nature Reviews. Microbiology, 19(8), 528–545. https://doi.org/10.1038/s41579-021-00535-6
Liu, R., Sheng, Z., Huang, C., Wang, D., & Li, F. (2020). Influenza D Virus. Current opinion in virology, 44, 154–161. https://doi.org/10.1016/j.coviro.2020.08.004
Liu, R., Fan, Y., Patel, A., Liu, H., Du, X., Liu, B., & Di Tanna, G. L. (2024). The association between influenza vaccination, cardiovascular mortality and hospitalization: A living systematic review and prospective meta-analysis. Vaccine, 42(5), 1034–1041. https://doi.org/10.1016/j.vaccine.2024.01.040
Lusignan, S. de, Tsang, R. S. M., Amirthalingam, G., Akinyemi, O., Sherlock, J., Tripathy, M., Deeks, A., Ferreira, F., Howsam, G., Hobbs, F. D. R., & Joy, M. (2021). Adverse events of interest following influenza vaccination, a comparison of cell culture-based with egg-based alternatives: English sentinel network annual report paper 2019/20. The Lancet Regional Health – Europe, 2. https://doi.org/10.1016/j.lanepe.2021.100029
Mahase, E. (2023). Flu deaths in UK hit five year high last winter. BMJ, 381, p1445. https://doi.org/10.1136/bmj.p1445
Maier, H. E., Lopez, R., Sanchez, N., Ng, S., Gresh, L., Ojeda, S., Burger-Calderon, R., Kuan, G., Harris, E., Balmaseda, A., & Gordon, A. (2018). Obesity Increases the Duration of Influenza A Virus Shedding in Adults. The Journal of Infectious Diseases, 218(9), 1378–1382. https://doi.org/10.1093/infdis/jiy370
Moghadami, M. (2017). A Narrative Review of Influenza: A Seasonal and Pandemic Disease. Iranian Journal of Medical Sciences, 42(1), 2–13.
Monto, A. S., Zambon, M., & Weir, J. P. (2024). The End of B/Yamagata Influenza Transmission—Transitioning from Quadrivalent Vaccines. The New England Journal of Medicine. https://doi.org/10.1056/NEJMp2314801
Neumann, G., Fan, S., & Kawaoka, Y. (2018). Selection of Antigenically Advanced Variants of Influenza Viruses. Methods in Molecular Biology (Clifton, N.J.), 1836, 461–486. https://doi.org/10.1007/978-1-4939-8678-1_22
O Murchu, E., Comber, L., Jordan, K., Hawkshaw, S., Marshall, L., O’Neill, M., Ryan, M., Teljeur, C., Carnahan, A., Pérez, J. J., Robertson, A. H., Johansen, K., Jonge, J. de, Krause, T., Nicolay, N., Nohynek, H., Pavlopoulou, I., Pebody, R., Penttinen, P., … Harrington, P. (2023a). Systematic review of the efficacy, effectiveness and safety of MF59® adjuvanted seasonal influenza vaccines for the prevention of laboratory-confirmed influenza in individuals ≥18 years of age. Reviews in Medical Virology, 33(3), e2329. https://doi.org/10.1002/rmv.2329
O Murchu, E., Comber, L., Jordan, K., Hawkshaw, S., Marshall, L., O’Neill, M., Ryan, M., Teljeur, C., Carnahan, A., Pérez, J. J., Robertson, A. H., Johansen, K., Jonge, J. de, Krause, T., Nicolay, N., Nohynek, H., Pavlopoulou, I., Pebody, R., Penttinen, P., … Harrington, P. (2023b). Systematic review of the efficacy, effectiveness and safety of recombinant haemagglutinin seasonal influenza vaccines for the prevention of laboratory-confirmed influenza in individuals ≥18 years of age. Reviews in Medical Virology, 33(3), e2331. https://doi.org/10.1002/rmv.2331
Osterholm, M. T., Kelley, N. S., Sommer, A., & Belongia, E. A. (2012). Efficacy and effectiveness of influenza vaccines: A systematic review and meta-analysis. The Lancet. Infectious Diseases, 12(1), 36–44. https://doi.org/10.1016/S1473-3099(11)70295-X
Our World in Data. (2019). Child mortality rate by cause. Ourworldindata.Org. https://ourworldindata.org/grapher/child-death-rates-by-cause
Patrozou, E., & Mermel, L. A. (2009). Does Influenza Transmission Occur from Asymptomatic Infection or Prior to Symptom Onset? Public Health Reports, 124(2), 193–196.
Paul-Ehrlich-Institut. (2023, Juli 13). Saisonale Influenza-Impfstoffe. Arzneimittel – Impfstoffe. https://www.pei.de/DE/arzneimittel/impfstoffe/influenza-grippe/influenza-node.html
Paul-Ehrlich-Institut. (2023, September 26). Influenza Season 2023/2024—20.2 Million Doses of Flu Vaccine Already Released. PEI Newsroom. https://www.pei.de/EN/newsroom/hp-news/2023/230926-influenza-season-2023-2024-vaccine-doses-released.html#
Principi, N., & Esposito, S. (2016). Severe influenza in children: Incidence and risk factors. Expert Review of Anti-Infective Therapy, 14(10), 961–968. https://doi.org/10.1080/14787210.2016.1227701
Puzelli, S., Di Martino, A., Facchini, M., Fabiani, C., Calzoletti, L., Di Mario, G., Palmieri, A., Affanni, P., Camilloni, B., Chironna, M., D’Agaro, P., Giannecchini, S., Pariani, E., Serra, C., Rizzo, C., Bella, A., Donatelli, I., Castrucci, M. R., & Italian Influenza Laboratory Network. (2019). Co-circulation of the two influenza B lineages during 13 consecutive influenza surveillance seasons in Italy, 2004-2017. BMC Infectious Diseases, 19(1), 990. https://doi.org/10.1186/s12879-019-4621-z
Radtke, R. (2024a). Inzidenz gemeldeter Fälle von Influenza („Grippe“) in Deutschland in den Jahren 2001 bis 2024. Statista. https://de.statista.com/statistik/daten/studie/1226353/umfrage/inzidenz-von-influenza-in-deutschland/
Radtke, R. (2024b). Wöchentliche Anzahl von Influenza-Fällen in Deutschland nach Art der Viren in den Grippesaisons 2021 bis 2023. Statista. https://de.statista.com/statistik/daten/studie/807491/umfrage/grippewelle-faelle-von-influenza-nach-art-der-viren/
Robert Koch-Institut. (2016, Dezember 5). Antworten auf häufig gestellte Fragen zu Pandemieplanung. Preparedness and Response. https://www.rki.de/SharedDocs/FAQ/Pandemieplanung/FAQ_Liste_Pandemieplanung.html?nn=12643086
Robert Koch-Institut. (2017, Januar 18). Influenzavirus. EM-Aufnahmen. https://www.rki.de/DE/Content/Infekt/NRZ/EM/Aufnahmen/EM_Tab_Influenza.html
Robert Koch-Institut. (2018, Januar 19). Influenza (Teil 1): Erkrankungen durch saisonale Influenzaviren. RKI-Ratgeber. https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_Influenza_saisonal.html
Robert Koch-Institut. (2019). Bericht zur Epidemiologie der Influenza in Deutschland Saison 2018/19. Arbeitsgemeinschaft Influenza. https://influenza.rki.de/Saisonberichte/2018.pdf
Robert Koch-Institut. (2022, Oktober). ARE-Wochenbericht des RKI – 39. KW (26.9. Bis 2.10.2022). Aktuelles zu akuten respiratorischen Erkrankungen. https://influenza.rki.de/Wochenberichte/2021_2022/2022-39.pdf
Robert Koch-Institut. (2023a, September 18). Antworten auf häufig gestellte Fragen zur Schutzimpfung gegen Influenza. Infektionskrankheiten A-Z. https://www.rki.de/SharedDocs/FAQ/Impfen/Influenza/FAQ_Uebersicht.html
Robert Koch-Institut. (2023b, September 18). Häufig gestellte Fragen und Antworten zur Grippe. Infektionskrankheiten A-Z. https://www.rki.de/SharedDocs/FAQ/Influenza/FAQ_Liste.html
Robert Koch-Institut. (2023c, Oktober). ARE-Wochenbericht des RKI – 38. KW (18.9. Bis 24.9.2023). Aktuelles zu akuten respiratorischen Erkrankungen. https://influenza.rki.de/Wochenberichte/2022_2023/2023-38.pdf
Robert Koch-Institut. (2024, April). ARE-Wochenbericht des RKI. Aktuelles zu akuten respiratorischen Erkrankungen 15. Kalenderwoche (8.4. bis 14.4.2024). https://influenza.rki.de/Wochenberichte/2023_2024/2024-15.pdf
Rößler, S., Ankert, J., Baier, M., Pletz, M. W., & Hagel, S. (2021). Influenza-associated in-hospital mortality during the 2017/2018 influenza season: A retrospective multicentre cohort study in central Germany. Infection, 49(1), 149–152. https://doi.org/10.1007/s15010-020-01529-x
Sanofi. (2023, August). Elfluelda Fachinformationen. mein.sanofi.de. https://mein.sanofi.de/.rest/api/gsa/v1/pdf/VV-LBL-0321793_9056541_2_0.pdf?dataURL=/resources/SPC/ChronID-002096/data
Sanofi Pasteur. (2023a). Supemtek Fachinformation. EMA. https://www.ema.europa.eu/en/documents/product-information/supemtek-epar-product-information_en.pdf
Sanofi Pasteur. (2023b, Juli). Vaxigrip Tetra Fachinformation. mein.sanofi.de. https://mein.sanofi.de/.rest/api/gsa/v1/pdf/VV-LBL-0321889_9059064_2_0.pdf?dataURL=/resources/SPC/0900972f8032c671/data
Sarda, C., Palma, P., & Rello, J. (2019). Severe influenza: Overview in critically ill patients. Current Opinion in Critical Care, 25(5), 449–457. https://doi.org/10.1097/MCC.0000000000000638
Sellers, S. A., Hagan, R. S., Hayden, F. G., & Fischer, W. A. (2017). The hidden burden of influenza: A review of the extra-pulmonary complications of influenza infection. Influenza and Other Respiratory Viruses, 11(5), 372–393. https://doi.org/10.1111/irv.12470
Seqirus. (2023a). Fluad Tetra Fachinformation. EMA. https://www.ema.europa.eu/en/documents/product-information/fluad-tetra-epar-product-information_de.pdf
Seqirus. (2023b, Juli 28). Afluria Tetra Fachinformation. Apotheken Umschau. https://www.apotheken-umschau.de/medikamente/beipackzettel/afluria-tetra-20232024-inj-suspf-sprokanuele-17620971.html
Seqirus. (2023c, Juli 28). Flucelvax Tetra Fachinformation. ema.europa.eu. https://www.ema.europa.eu/en/documents/product-information/flucelvax-tetra-epar-product-information_de.pdf
Smetana, J., Chlibek, R., Shaw, J., Splino, M., & Prymula, R. (2017). Influenza vaccination in the elderly. Human Vaccines & Immunotherapeutics, 14(3), 540–549. https://doi.org/10.1080/21645515.2017.1343226
Streng, A., Grote, V., & Liese, J. G. (2011). Severe influenza cases in paediatric intensive care units in Germany during the pre-pandemic seasons 2005 to 2008. BMC Infectious Diseases, 11, 233. https://doi.org/10.1186/1471-2334-11-233
Sukumaran, L., McCarthy, N. L., Kharbanda, E. O., Vazquez-Benitez, G., Lipkind, H. S., Jackson, L., Klein, N. P., Naleway, A. L., McClure, D. L., Hechter, R. C., Kawai, A. T., Glanz, J. M., & Weintraub, E. S. (2018). Infant Hospitalizations and Mortality After Maternal Vaccination. Pediatrics, 141(3), e20173310. https://doi.org/10.1542/peds.2017-3310
Thomas, R. E., Jefferson, T., & Lasserson, T. J. (2013). Influenza vaccination for healthcare workers who care for people aged 60 or older living in long‐term care institutions. Cochrane Database of Systematic Reviews, 7. https://doi.org/10.1002/14651858.CD005187.pub4
Tricco, A. C., Chit, A., Soobiah, C., Hallett, D., Meier, G., Chen, M. H., Tashkandi, M., Bauch, C. T., & Loeb, M. (2013). Comparing influenza vaccine efficacy against mismatched and matched strains: A systematic review and meta-analysis. BMC Medicine, 11, 153. https://doi.org/10.1186/1741-7015-11-153
Uemura, K., Ono, S., Michihata, N., Yamana, H., & Yasunaga, H. (2023). Duration of influenza vaccine effectiveness in the elderly in Japan: A retrospective cohort study using large-scale population-based registry data. Vaccine, 41(19), 3092–3098. https://doi.org/10.1016/j.vaccine.2023.03.066
Viatris Healthcare. (2023, Juni). Influvac Tetra Fachinformation. uni.siegen.de. https://www.uni-siegen.de/start/zielgruppen/mitarbeiterinnen_und_mitarbeiter/serviceportal/gesundheit/angebote/fi_influvac_tetra_saison_2023-2024.pdf
Viatris Healthcare. (2023, Juni). Xanaflu Tetra Fachinformation. Apotheken Umschau. https://www.apotheken-umschau.de/medikamente/beipackzettel/xanaflu-tetra-saison-20232024-fertigsprmkanuele-18272756.html
Vijaykrishna, D., Mukerji, R., & Smith, G. J. D. (2015). RNA Virus Reassortment: An Evolutionary Mechanism for Host Jumps and Immune Evasion. PLoS Pathogens, 11(7), e1004902. https://doi.org/10.1371/journal.ppat.1004902
Walsh, L. K., Donelle, J., Dodds, L., Hawken, S., Wilson, K., Benchimol, E. I., Chakraborty, P., Guttmann, A., Kwong, J. C., MacDonald, N. E., Ortiz, J. R., Sprague, A. E., Top, K. A., Walker, M. C., Wen, S. W., & Fell, D. B. (2019). Health outcomes of young children born to mothers who received 2009 pandemic H1N1 influenza vaccination during pregnancy: Retrospective cohort study. BMJ, 366, l4151. https://doi.org/10.1136/bmj.l4151
Wilkinson, K., Wei, Y., Szwajcer, A., Rabbani, R., Zarychanski, R., Abou-Setta, A. M., & Mahmud, S. M. (2017). Efficacy and safety of high-dose influenza vaccine in elderly adults: A systematic review and meta-analysis. Vaccine, 35(21), 2775–2780. https://doi.org/10.1016/j.vaccine.2017.03.092
Wolfe, D. M., Fell, D., Garritty, C., Hamel, C., Butler, C., Hersi, M., Ahmadzai, N., Rice, D. B., Esmaeilisaraji, L., Michaud, A., Soobiah, C., Ghassemi, M., Khan, P. A., Sinilaite, A., Skidmore, B., Tricco, A. C., Moher, D., & Hutton, B. (2023). Safety of influenza vaccination during pregnancy: A systematic review. BMJ Open,13(9), e066182. https://doi.org/10.1136/bmjopen-2022-066182
World Health Organization. (2023, Januar 12). Influenza (Seasonal). Fact Sheets. https://www.who.int/news-room/fact-sheets/detail/influenza-(seasonal)
World Health Organization. (2024, Februar 23). Recommended composition of influenza virus vaccines for use in the 2024-2025 northern hemisphere influenza season. Who.Int. https://www.who.int/publications/m/item/recommended-composition-of-influenza-virus-vaccines-for-use-in-the-2024-2025-northern-hemisphere-influenza-season
Zanobini, P., Bonaccorsi, G., Lorini, C., Haag, M., McGovern, I., Paget, J., & Caini, S. (2022). Global patterns of seasonal influenza activity, duration of activity and virus (sub)type circulation from 2010 to 2020. Influenza and Other Respiratory Viruses, 16(4), 696–706. https://doi.org/10.1111/irv.12969
Stand: 24. April 2024
Nächste Aktualisierung: 24. Oktober 2024