Kostenlos: der ÄFI-Newsletter
Bleiben Sie auf dem Laufenden beim Thema
Impfungen & Impfentscheidung und rund um den Verein.
Frühsommer-Meningoenzephalitis (FSME)
Ist das Risiko für einen schweren Verlauf einer FSME-Infektion für Kinder und Jugendliche so hoch wie für Erwachsene? Welche Risikofaktoren und Schutzmaßnahmen sind bekannt? Welche Risikogebiete gibt es und inwiefern unterscheiden sich die Definitionen von RKI und WHO? Sind die Impf-Empfehlungen der STIKO aus Sicht von ÄFI nachvollziehbar? Antworten auf diese und weitere Fragen finden Sie im nachfolgenden Fachbeitrag.
Vorbemerkung
Die folgenden Ausführungen dienen der Information und ersetzen keinesfalls das ärztliche Beratungsgespräch. Hier werden Fakten präsentiert, die Eltern wie auch Ärztinnen und Ärzten in einem Aufklärungsgespräch helfen können. Ärztinnen und Ärzte für individuelle Impfentscheidung e. V. (ÄFI) übernimmt keine Garantie für Vollständigkeit, hat die hier verfügbaren Inhalte jedoch nach bestem Wissen und Gewissen am aktuellen Fach- und Sachstand zusammengetragen. Über die wissenschaftliche Arbeit des Vereins erfahren Sie hier mehr. Der Fachbeitrag wird jährlich aktualisiert. Das dargelegte Wissen entspricht dem Kenntnisstand zum angegebenen Veröffentlichungs- bzw. Aktualisierungsdatum. Weitere Informationen erhalten Sie auch in unserem Podcast.
Im Podcast anhören
Fachbeitrag
- FSME: Die Erkrankung
Erreger
- Flavivirus aus der Familie der Flaviviridae
- Laut RKI gibt es weltweit drei Virussubtypen (europäisch, sibirisch, fernöstlich). Es wurden aber auch zwei neue Typen beschrieben (himalayisch und baikalisch) (Ruzek et al., 2019).
- Der in Deutschland vorkommende europäische Subtyp wird hauptsächlich durch die Zeckenart Ixodes ricinus (Gemeiner Holzbock) übertragen.
- Der deutsche Begriff Frühsommer-Meningoenzephalitis (FSME) bezeichnet den Zeitpunkt des häufigsten Auftretens und das Vollbild der Erkrankung, die durch den europäischen Subtyp hervorgerufen wird. Der englische Begriff Tick-borne encephalitis (TBE) umfasst dagegen alle Virussubtypen.
- Sehr viel häufiger als FSME überträgt die genannte Zeckenart Ixodes ricinus das Bakterium Borrelia burgdorferi (Borrelien), das beim Menschen die Lyme-Borreliose auslösen kann. Es wird angenommen, dass 10 bis 35 % der heimischen Zecken mit Borrelien infiziert sind. Zudem gibt es im Gegensatz zu FSME keine spezifischen Risikogebiete, sondern das Bakterium wird deutschlandweit übertragen (Robert Koch-Institut, 2022a).
(Robert Koch-Institut, 2022a)
Infektionsmodus
- Über Zeckenstich, in seltenen Fällen auch über rohe bzw. nicht pasteurisierte Milchprodukte von Kühen, Schafen und Ziegen möglich (Robert Koch-Institut, 2022a; Bundeszentrale für gesundheitliche Aufklärung, 2023).
- Im Gegensatz zur Borreliose, für welche das Risiko einer Ansteckung mit der Zeit ansteigt und wahrscheinlich zwischen 48 und 72 Stunden nach Beginn des Zeckenstiches am höchsten ist, ist das Risiko einer Übertragung von FSME unmittelbar nach Beginn des Saugens hoch (Kollaritsch et al., 2012; Cook, 2015; Bublak, 2020).
- Keine Übertragung von Mensch zu Mensch möglich, ebenso wurde bisher keine vertikale Transmission (einer FSME-infizierten Schwangeren auf den Fötus) festgestellt (Robert Koch-Institut, 2022a).
- Die Inkubationszeit liegt zwischen 5 und 28 Tagen (Kaiser, 2016), durchschnittlich bei 7 bis 14 Tagen (Robert Koch-Institut, 2022a).
- Der Saugmechanismus von Zecken gleicht eher einem Stich als einem Biss, daher wird in der deutschen Literatur (und auch in diesem Fachbeitrag) von einem Zeckenstich gesprochen (Robert Koch-Institut, 2022b).
- FSME ist als Berufskrankheit Nr. 3102 meldepflichtig und der serologische Nachweis ist laut IfSG dem örtlichen Gesundheitsamt namentlich zu melden (Kaiser, 2016).
Infektionsverlauf
- Das Robert Koch-Institut gibt den Anteil an asymptomatischen Fällen mit 70 bis 95 % an, es werden in der Literatur aber auch Manifestationsraten von 33 % (bzw. 67 % asymptomatische Fälle) genannt. Da Zecken durchschnittlich zu 1 bis 3 % in endemischen Gebieten mit FSME infiziert sind, ergibt sich ungefähr alle 100 bis 300 Zeckenstiche eine Erkrankung (Kaiser, 2016; Robert Koch-Institut, 2022a).
- Dies würde bedeuten, dass es im Jahr 2022 mindestens 30.000 bis 90.000 Zeckenstiche mit FSME-Viren gab, um die 300 an das RKI übermittelten Erkrankungen mit neurologischen Manifestationen (Meningitis, Enzephalitis oder Myelitis) zu verursachen (Robert Koch-Institut, 2023b).
Klinisches Bild: virale Infektion des zentralen Nervensystems mit biphasischem Verlauf:
- In der ersten (febrilen) Phase mit einer Dauer von 2 bis 7 Tagen treten grippeähnliche Beschwerden wie Fieber, Kopf- und Gliederschmerzen auf.
- Auf die erste Phase folgt ein symptomarmes bis asymptomatisches (afebriles) Intervall, das durch das Sinken des Fiebers gekennzeichnet ist. Es werden unterschiedliche Angaben über die Länge des Intervalls gemacht: Das RKI spricht von bis zu 7 Tagen, während Wendt et al. (2019) eine Länge von bis zu 10 Tagen angeben. Bei schätzungsweise einem Drittel der FSME-Fälle folgt dann eine zweite Krankheitsphase.
- In der zweiten (febrilen) Phase steigt das Fieber wieder und es treten die neurologischen Manifestationen auf, die typisch für das Krankheitsbild sind. Etwa 50 % der Patienten, die in die zweite Phase übergehen, leiden an Meningitis, 40 % an Meningoenzephalitis und 10 % Meningoenzephalomyelitis.
- Bei etwa 30 % der Patienten, die in die zweite Krankheitsphase eintreten, sind anhaltende Komplikationen zu erwarten, welche die Lebensqualität einschränken.
(Blom et al., 2018; Wendt et al., 2019; Robert Koch-Institut, 2022a)

Abbildung 1: Überblick über das klassische biphasische Krankheitsbild der FSMEV-Infektion beim Menschen. Eigene Darstellung in Anlehnung an Blom et al. (2018), Quellen im Text. Zur Vergrößerung bitte hier klicken.
Die Mortalität fällt in der Literatur sehr unterschiedlich für die jeweiligen Subtypen aus.- Für den europäischen (TBEV-Eu) und sibirischen Subtyp (TBEV-Sib) werden Angaben zwischen 0,5 und 3 % gemacht. Meist kommen Studien zur Infektionssterblichkeit für den europäischen Subtyp auf einen Wert von 1 %, auf jeden Fall aber unter 2 % (Kollaritsch et al., 2012; Ruzek et al., 2019).
- Laut Ruzek et al. (2019) stammen die bisher validesten Daten zur Infektionssterblichkeit – trotz der unterschiedlichen Definitionen der Länder – vom 2018 veröffentlichten epidemiologischen Jahresbericht für FSME für 2015 des European Centre for Disease Prevention and Control (ECDC). Bei fünf Todesfällen auf 1908 bestätigte FSME-Fälle wurde eine IFR von 0,2 % berechnet.
- Für den fernöstlichen Typ (TBEV-FE) werden sehr unterschiedliche Angaben von 15 bis 20 %, bis zu 30 %, aber auch bis 40 % gemacht (Kaiser, 2016; Wendt et al., 2019; Yoshii, 2019).
- Der hohe Anteil an asymptomatischen Fällen beim europäischen Subtyp führt gleichzeitig zu einer hohen Dunkelziffer, insbesondere bei Kindern und Jugendlichen, welche die Berechnung der Mortalität erschwert (Kollaritsch et al., 2012).
- Die Therapie erfolgt zur Linderung der Symptome, es gibt keine spezifischen antiviralen Arzneimittel gegen FSME (Robert Koch-Institut, 2022a).
Pathogenese
Erste Virämiephase:
- Das Flavivirus infiziert die Langerhans-Zellen in der Haut, vermehrt sich dort und nutzt sie anschließend, um in die Lymphknoten zu gelangen.
- In den Lymphorganen werden Lymphozyten und Makrophagen infiziert, wodurch das Abwehrsystem des Körpers beeinträchtigt wird.
Zweite Virämiephase:
- Infektion des Nervensystems
- Das Flavivirus befällt die Epithelzellen der Hirnhäute, die Purkinje-Zellen im Kleinhirn, die motorischen Kerne im Hirnstamm und Rückenmark und die Zellverbände im Thalamus, Dienzephalon und Mesenzephalon.
(Kaiser, 2016)
Komplikationen
Meningitis
Enzephalitis
Myelitis
Allgemeinsymptome
Reduziertes Allgemeinbefinden, Fieber
Häufig
Kopfschmerzen
Quantitative Bewusstseinsstörungen (Sopor, Koma)
Schlaffe Extremitätenparesen
Qualitative Bewusstseinsstörungen (Delir, Halluzinationen)
Blasenstörung
Störungen der Kognition, Ataxie, Extremitätenparesen
Gelegentlich
Nackensteifigkeit
Tremor
Spasmen der Blasenmuskulatur
Neuritis der Hirnnerven III, V–XII
Mimisches Beben, Zentrale Atemstörung, Dysphagie, Anfälle
Schmerzen im Bereich von Rumpf und Extremitäten
Tabelle 1: Symptome der Frühsommer-Meningoenzephalitis (Kaiser, 2016), modifiziert.
Prävention
- Ausführliche Informationen zu den Impfstoffen finden Sie unter FSME: Die Impfung.
- Die WHO listet eine Reihe von Schutzmaßnahmen für FSME-Risikogebiete:
„Menschen können sich vor Zecken schützen, indem sie beim Wandern oder Zelten in gefährdeten Ländern oder Gebieten geeignete Kleidung tragen, darunter lange Hosen und geschlossenes Schuhwerk. Der ganze Körper sollte täglich inspiziert werden, und festsitzende Zecken sollten so schnell wie möglich entfernt werden. Auch der Verzehr von unpasteurisierten Milchprodukten sollte in diesen Gebieten vermieden werden“ (World Health Organization, 2023) (Übersetzung des Verfassers). - Ergänzend zu den Schutzmaßnahmen sei helle und geschlossene Kleidung genannt, wodurch Zecken besser zu erkennen sind. Repellents haben eine gute Wirkung auf das Verhindern des Stiches, diese hält jedoch meist nur wenige Stunden an (Kaiser, 2016).
- Die Anwendung von 2 oder mehr Zeckenschutzmaßnahmen (OR = 0,52, 95%) sowie das Mähen von Rasenflächen (OR = 0.63, 95%) war in einer süddeutschen Fall-Kontroll-Studie im Zeitraum von 2018 bis 2020 mit einem geringeren Risiko einer FSME-Infektion verbunden (Nygren et al., 2022a).
Prognose
- In der Frühphase der Infektion kann das Virus per PCR-Test nachgewiesen werden, wodurch frühzeitig mit einer symptomatischen Therapie begonnen werden kann (Kollaritsch et al., 2012).
- Mit zunehmendem Alter steigt das Risiko für einen schweren Verlauf. Kinder und Jugendliche sind etwa 10-fach seltener von einem schweren Verlauf betroffen als Erwachsene (Kaiser, 2016).
- Bei bis zu 58 % der über 15-Jährigen wurden langfristige oder dauerhafte Funktionsstörungen nach dem Vollbild der Erkrankung beobachtet (Kaiser, 2016).
Risikofaktoren (in Risikogebieten) für einen Zeckenstich mit FSME-Übertragung sind:
- Alter (vor allem ab 50 Jahren)
- forst- und landwirtschaftlicher Beruf
- Hundehaltung
- Gartenarbeit und Gartennähe mit < 250 m Entfernung zu Wäldern
- häufige Spaziergänge (> 4x pro Woche) und Wanderungen
(Kollaritsch et al., 2012; Chrdle et al., 2016; Kaiser, 2016; Nygren et al., 2022a)
Epidemiologie
Es gibt unterschiedliche Angaben über FSME-Hochrisikogebiete durch das Robert Koch-Institut und die WHO, die auf den verschiedenen Definitionen beruhen:
- Im Epidemiologischen Bulletin des RKI wird definiert: „Ein Kreis wird als FSME-Risikogebiet definiert, wenn die Anzahl der übermittelten FSME-Erkrankungen in mindestens einem der 17 Fünfjahreszeiträume im Zeitraum 2002 – 2022 im Kreis ODER in der Kreisregion (bestehend aus dem betreffenden Kreis plus allen angrenzenden Kreisen) signifikant (p < 0,05) höher liegt als die bei einer Inzidenz von 1 Erkrankung pro 100.000 Einwohner erwartete Fallzahl“ (Robert Koch-Institut, 2023b).
- Die WHO schreibt im Positionspapier von 2011 demgegenüber: „In Gebieten, in denen die Krankheit stark endemisch ist (d. h. in denen die durchschnittliche Inzidenz klinischer Erkrankungen vor der Impfung ≥ 5 Fälle/100 000 Einwohner pro Jahr beträgt), was bedeutet, dass ein hohes individuelles Infektionsrisiko besteht, empfiehlt die WHO, die Impfung allen Altersgruppen, einschließlich Kindern, anzubieten“ (Übersetzung des Verfassers) (World Health Organization, 2011).
- Für die Definition der WHO werden demnach 25 mal mehr FSME-Fälle benötigt, um ein FSME-Risikogebiet zu deklarieren. Zudem scheint die Definition des Robert Koch-Institutes keine veränderte Lage zuzulassen, da bereits ein Hochrisikogebiet vorliegt, wenn ausschließlich bei einem der angegebenen Fünfjahreszeiträume (beispielsweise 2002 bis 2006) der Grenzwert überschritten wird.
- Während das RKI 178 Risikogebiete ausweist, sind es nach der WHO nur 55.
- Eine 2023 im Fachjournal Eurosurveillance veröffentlichte Studie mit Daten des Zentralmeldesystems der EU kommt zu dem Ergebnis, dass in den 15 analysierten Ländern nur sehr wenige Regionen (insgesamt 50) die Definition der WHO für ein Risikogebiet erfüllen. Die Grafik (Nr. 1) der Autoren zu den Melderaten der durch Zecken übertragenen Enzephalitisfälle pro 100.000 Einwohner von 2012 bis 2020 kann hier abgerufen werden (Heuverswyn et al., 2023). Den Zahlen der Studie ist zu entnehmen, dass ca. 10 Menschen pro Jahr (in dem untersuchten Zeitraum 2012-2022) an einer FSME in den 15 untersuchten Ländern verstorben sind.
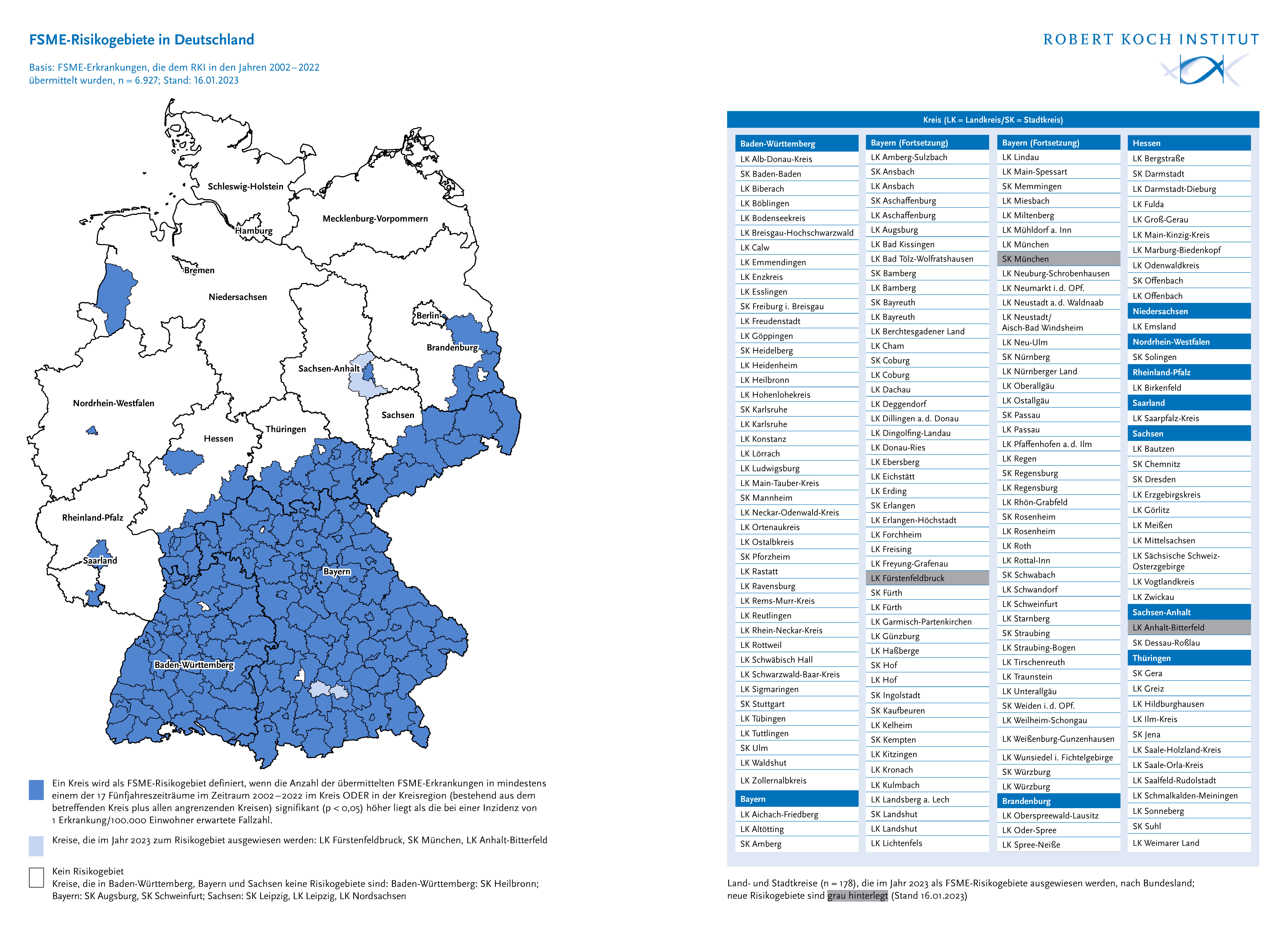
Abbildung 2: FSME-Risikogebiete in Deutschland nach Definition des RKI. Bei der letzten Aktualisierung am 16. Januar 2023 hat das RKI 6 neue Risikogebiete ausgewiesen (Robert Koch-Institut, 2023b). Zur Vergrößerung bitte hier klicken.

Abbildung 3: Vergleich der nach RKI und WHO definierten Risikogebiete. Die hier in rot dargestellten Landkreise sind Risikogebiete nach der Definition der WHO, nach welcher über 5 Fälle pro 100.000 Einwohner und pro Jahr nötig sind (Rabe, 2023). Zur Vergrößerung bitte hier klicken.
- Jährlich gibt es weltweit etwa 10.000-15.000 Fälle, wovon nahezu die Hälfte aus Russland stammt. Die am stärksten betroffenen Regionen in Europa befinden sich in Österreich, Süddeutschland (vor allem Bayern, Baden-Württemberg, Hessen, Rheinland-Pfalz), der Tschechischen Republik und Slowenien sowie den baltischen Staaten und den südlichen Teilen Skandinaviens (Chrdle et al., 2016; Robert Koch-Institut, 2022a).
- Es gibt jährlich einige Dutzend erkannte FSME-Fälle, die von einem endemischen Land in ein anderes importiert wurden. Wie hoch das Risiko von FSME als Reisekrankheit ist, ist unter anderem wegen nicht diagnostizierter oder fehldiagnostizierter Fälle schwer quantifizierbar, wie Übersichtsarbeiten zeigen (Chrdle et al., 2016; Steffen, 2016).
- Die in Europa in den letzten drei Jahren gestiegene Anzahl an FSME-Fällen sei hauptsächlich auf den Einsatz von non-pharmazeutischen Interventionen und die daraus resultierende Veränderung der Verhaltensweisen (z. B. vermehrter Aufenthalt in Gärten und Spaziergänge in Wäldern sowie Outdoor-Aktivitäten) während der COVID-19-Pandemie zurückzuführen (Nygren et al., 2022a; Heuverswyn et al., 2023).
- In endemischen Gebieten sind im Durchschnitt 1-3 % der Zecken mit FSME infiziert (Kaiser, 2016).
- Bei bodennahen Temperaturen über 5 Grad Celsius und Wochenmitteltemperaturen von über 15 Grad Celsius, wie sie von Sommer bis Herbst üblich sind, können sich die Viren besser vermehren, was zu einer höheren Virusdosis und einer höheren relativen Wahrscheinlichkeit für eine FSME-Erkrankung pro Zeckenstich führt (Daniel et al., 2018).
- FSME: Die Impfung
- Es sind zwei Impfstoffe in Deutschland und den meisten anderen europäischen Ländern zugelassen. FSME-IMMUN® und ENCEPUR® (Paul-Ehrlich-Institut). Sie basieren auf europäischen Stämmen des Virus (World Health Organization, 2011).
- Zwei weitere Impfstoffe (TBE vaccine Moscow (TBE-Moscow) und EnceVir) werden in Russland produziert. Sie basieren auf fernöstlichen Stämmen (World Health Organization, 2011).
- Je nach Impfstoff handelt es sich entweder um einen Adsorbatimpfstoff (ein Antigen wird an ein Adjuvanz gebunden) oder einen Ganzvirusimpfstoff (ganzes Virus, das abgetötet wurde)
FSME-IMMUN®
- Basiert auf dem Neudröffl-Strang
- Humanes Serum Albumin wird als Stabilisator verwendet
- Enthält 2,4 µg (Erwachsene) bzw. 1,2 µg (Kinder) Antigen
- Kann Spuren von Formaldehyd enthalten, das zur Abtötung der Viren genutzt wird (World Health Organization, 2011).
- Impfschema:
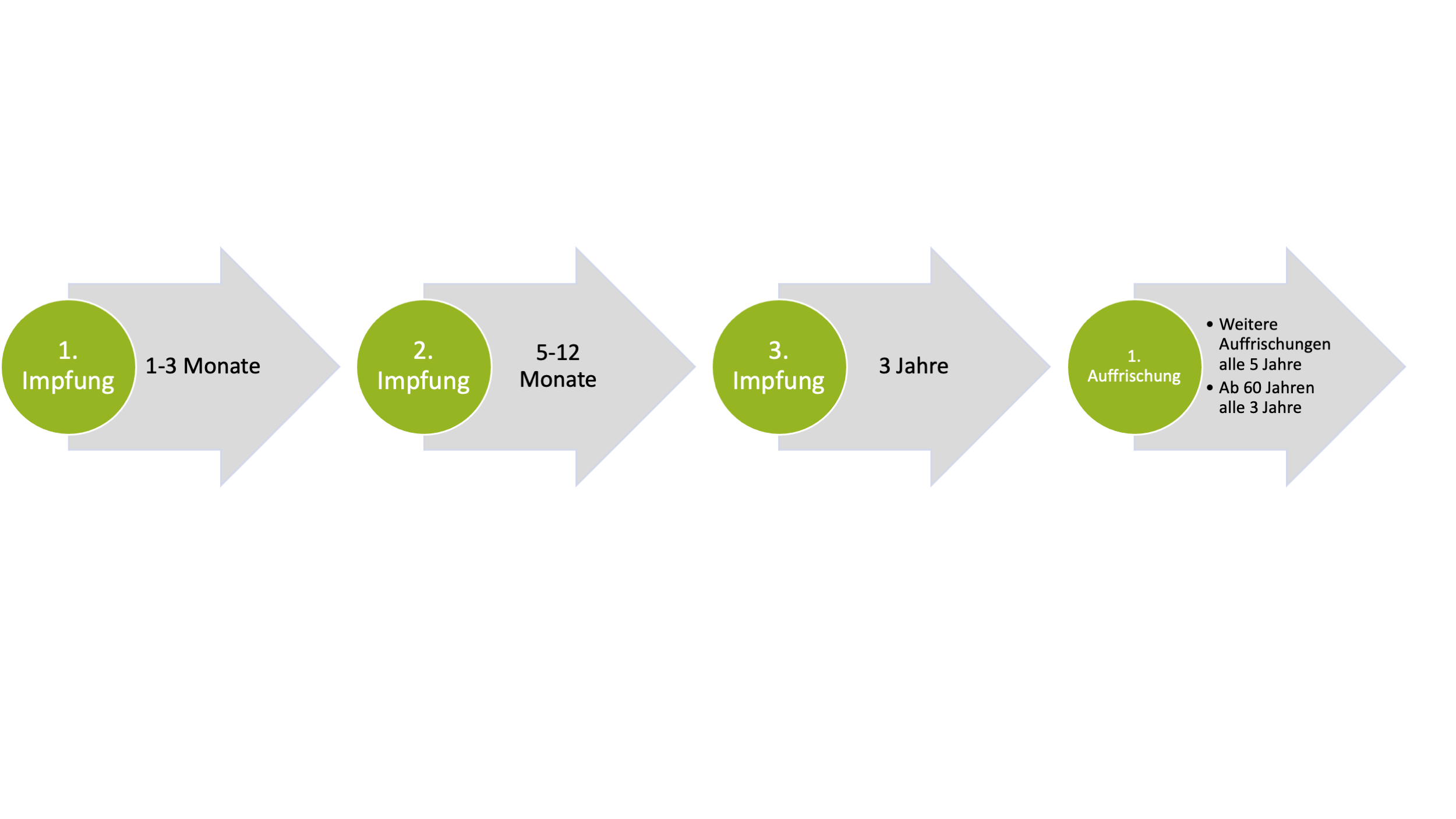
Zur Vergrößerung bitte hier klicken.
ENCEPUR®
- Basiert auf dem K23-Strang
- Sucrose wird als Stabilisator verwendet
- Enthält 1,5 µg (Erwachsene) bzw. 0,75 µg (Kinder) Antigen
- Kann die Antibiotika Neomycin, Gentamicin und Chlortetracyclin enthalten (World Health Organization, 2011)
- Impfschema:
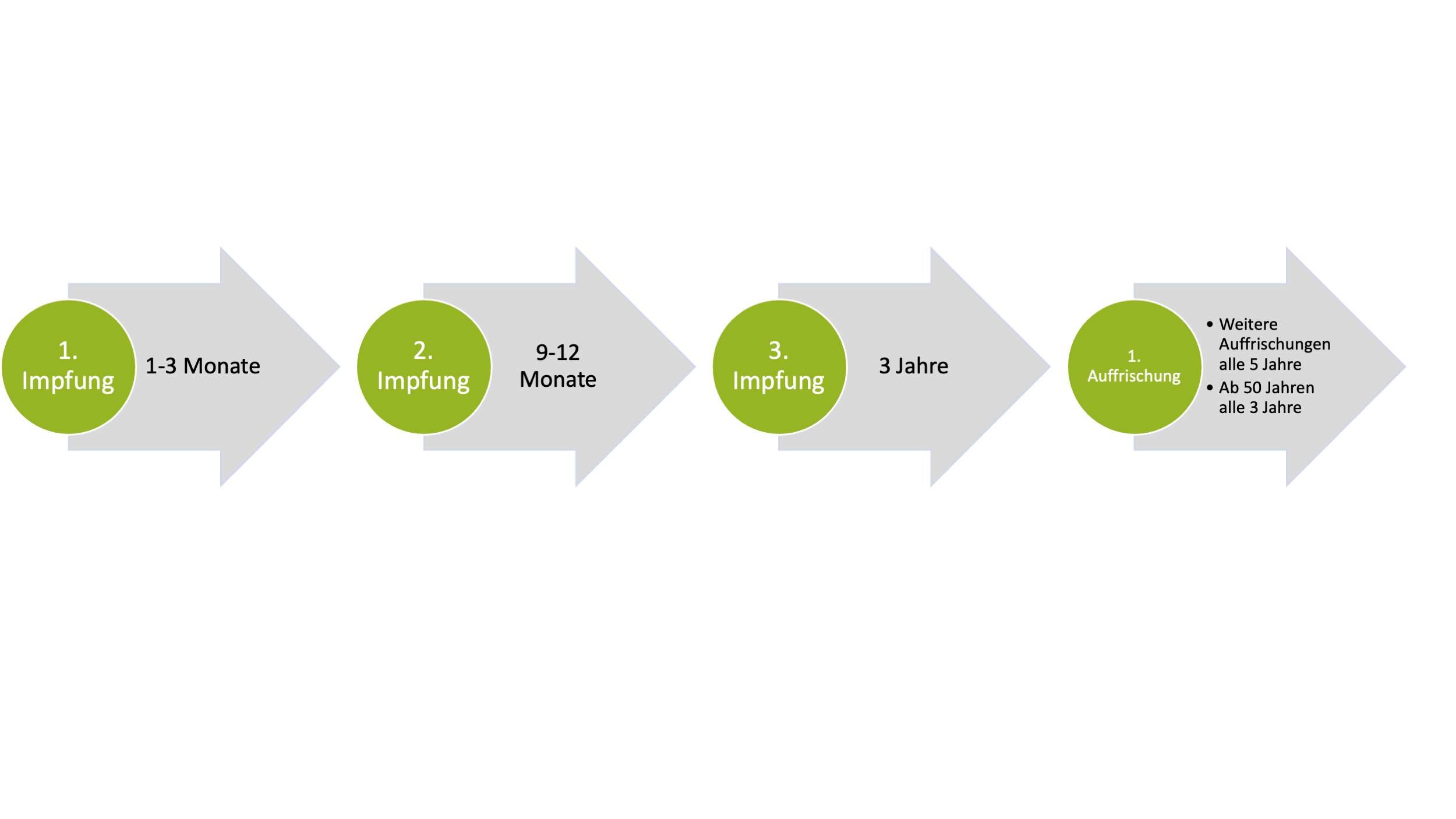
Zur Vergrößerung bitte hier klicken.
- Eine Impfung ist möglich ab einem Lebensalter von einem Jahr (Paul-Ehrlich-Institut, 2023).
- Ein Schnellverfahren ist möglich, bei dem die zweite und dritte Impfung 7 und 21 Tage nach der ersten erfolgen und eine vierte nach 12-18 Monaten gegeben werden sollte
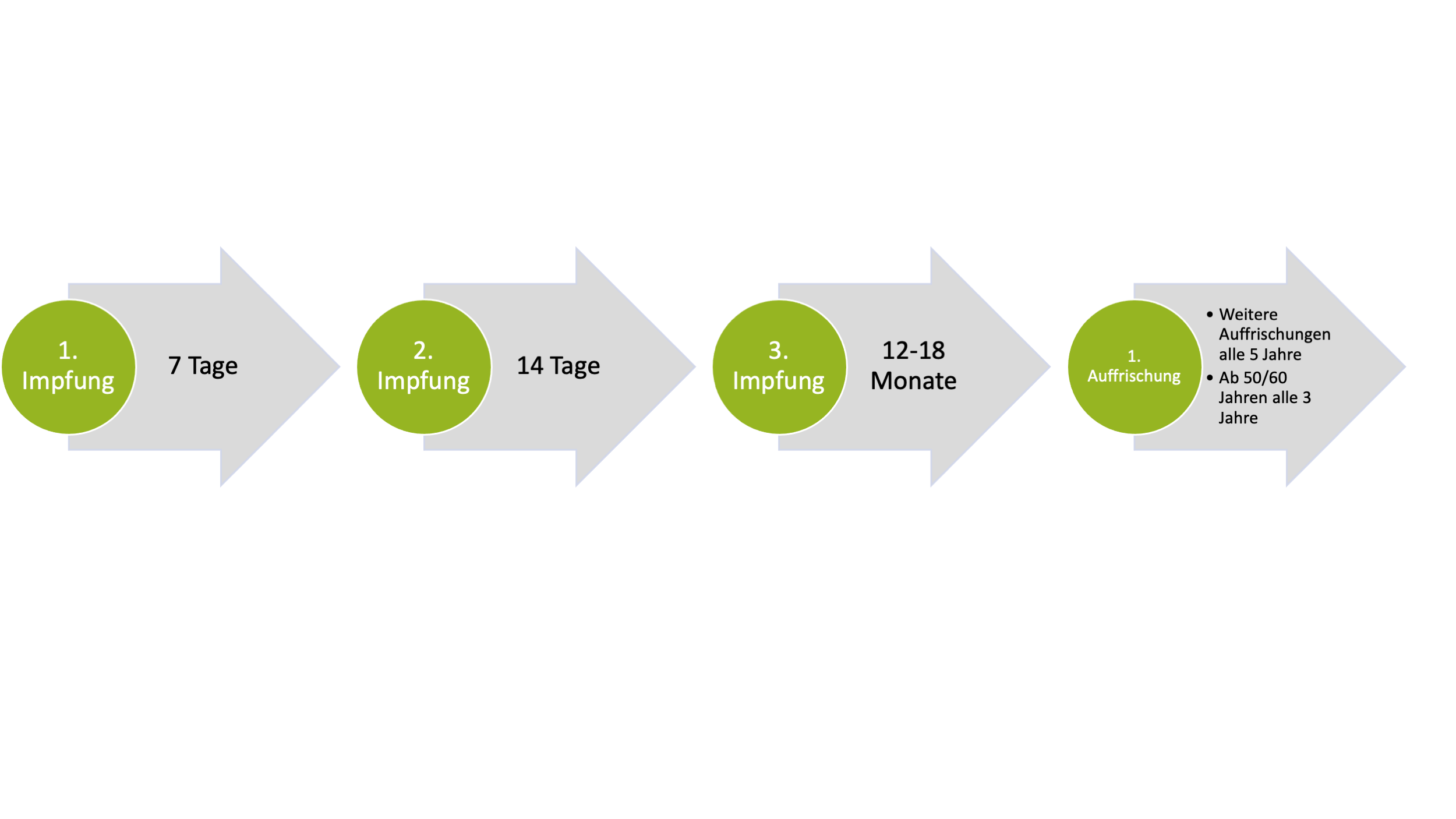
Zur Vergrößerung bitte hier klicken.
- Drei Jahre nach der letzten Impfung der Grundimmunisierung sollte eine Auffrischung erfolgen, danach alle 5 Jahre (bzw. auch alle 3 Jahre für Menschen über 50/60 Jahren)
Wirksamkeit
- Die Wirksamkeit der Impfstoffe hinsichtlich der Vermeidung von Krankheit wurde nicht in randomisiert kontrollierten Studien (RCTs) getestet, sodass keine Aussage über den Effekt der Impfung auf das Auftreten der Symptome der Krankheit getroffen werden kann (World Health Organization, 2011).
- Wie bei anderen Impfungen auch, wird die Wirksamkeit der FSME-Impfung über das Messen von Antikörpern bewertet (World Health Organization, 2011).
- Im Jahr 2020 waren von 706 übermittelten FSME-Fällen 62 (9 %) geimpft. Davon lagen bei 50 Fällen ausreichend Informationen zum Impfstatus vor, von denen 11 (22 %) nach der Definition der STIKO ausreichend geimpft waren (Robert Koch-Institut, 2021).
- Ein Cochrane Review untersuchte mehrere Studien, die zwar aufgrund fehlender Daten nicht die klinische Wirksamkeit der Impfstoffe betrachteten, aber eine Serokonversionsrate von über 87 % berichteten (Demicheli et al., 2009).
- Die einzigen Daten, die Rückschlüsse auf eine Wirksamkeit der Impfungen hinsichtlich der Vermeidung von Krankheit haben, basieren auf Beobachtungen in Österreich. Dort lag 1981 vor Einführung der Impfungen die FSME-Rate bei 600 Fällen pro Jahr. Nach der flächendeckenden Impfung von bis zu 90 % der Bevölkerung, wurden nur noch 40-60 Fälle in den Jahren 1999-2001 berichtet, sodass in Hochrisikogebieten wie Österreich auch eine hohe klinische Wirksamkeit erwartet werden kann (Kunz, 2003).
- Nach einer Boosterimpfung scheinen die Antikörperspiegel für mehr als 6 Jahre (Paulke-Korinek et al., 2009) bzw. mehr als 8 Jahre (Kollaritsch et al., 2012) stabil zu sein. Dabei treten Durchbruchinfektionen unabhängig vom zeitlichen Abstand zur letzten Impfung auf. Eine 2022 veröffentlichte Studie aus der Schweiz findet selbst nach zehn Jahren noch eine hohe Impfeffektivität von 98,5 % (Zens et al., 2022). Eine deutsche Studie von 2022 gibt zu bedenken, dass die hohe Impfeffektivität Entscheidungsträger dazu veranlassen könnte, das Auffrischungsintervall auf 10 Jahre zu erhöhen (Nygren et al., 2022b).
- Menschen, die älter als 50 Jahre sind, haben geringere Antikörperspiegel nach der Boosterimpfung und ggf. auch einen kürzeren Impfschutz (Rampa et al., 2020).
- Vor allem aufgrund der geringeren Wirksamkeit der Impfstoffe in den höheren Altersgruppen, den unbekannten Wirkmechanismen der zugelassenen Impfstoffe und der steigenden Verbreitung von FSME wird eine Überarbeitung der Impfstoffe und Impfstrategien gefordert (Kubinski et al., 2020).
Nebenwirkungen
- In randomisiert-kontrollierten Studien und den Zulassungsstudien konnten laut WHO keine schweren Nebenwirkungen beobachtet werden (World Health Organization, 2011).
Erwachsene
FSME-IMMUN Erwachsene®
ENCEPUR Erwachsene®
Sehr häufig (≥ 1/10)
Reaktionen an der Injektionsstelle: z. B. Schmerzen
Kopfschmerzen, Myalgie, Schmerzen an der Einstichstelle, Unwohlsein
Häufig (≥ 1/100 bis < 1/10)
Kopfschmerzen, Übelkeit, Myalgie, Arthralgie, Müdigkeit, Krankheitsgefühl
Übelkeit, Arthralgie, Fieber > 38°C, Erythem, Ödem an der Einstichstelle
Gelegentlich (≥ 1/1.000 bis < 1/100)
Lymphadenopathie, Erbrechen, Fieber, Blutung an der Injektionsstelle
Erbrechen
Selten (≥ 1/10.000 bis < 1/1.000)
Überempfindlichkeit, Schläfrigkeit, Schwindel, Durchfall, Bauchschmerzen, Reaktionen an der Injektionsstelle wie: Rötung, Verhärtung, Schwellung, Juckreiz, Missempfindungen, Wärmegefühl, Herpes Zoster, Auftreten oder Verschlimmerung von Autoimmunerkrankungen (z. B. Multiple Sklerose), anaphylaktische Reaktion, Demyelinisierende Erkrankungen (z. B. akute disseminierte Enzephalomyelitis, Guillain-Barré-Syndrom, Myelitis, Myelitis transversa), Enzephalitis, Krämpfe, aseptische Meningitis, Meningismus, Störungen der Sinnesempfindungen und Bewegungsstörung (Gesichtslähmung, Lähmung/Parese, Neuritis, Hypästhesie, Parästhesie), Geruchsverlust (Vodicka, 2010), Neuralgie, Sehnerventzündung, Benommenheit, Sehverschlechterungen, Lichtscheu, Augenschmerzen, Tinnitus, Tachykardie (Herzrasen), Dyspnoe (Atemnot), Urtikaria, Hautausschlag, Juckreiz, Dermatitis, Erythem, Hyperhidrosis, Rückenschmerzen, Gelenkschwellung, Nackenschmerzen, muskuloskelettale Steifigkeit (einschließlich Nackensteifigkeit), Schmerzen in den Extremitäten, Gangstörung, Schüttelfrost, grippeähnliche Symptome, Asthenie, Ödeme, Bewegungseinschränkung eines Gelenkes an der Injektionsstelle wie Gelenkschmerz, Knötchen und Entzündung
Ohne Angabe der Häufigkeit
Lymphadenopathie, allergische Reaktionen, unspezifische Sehstörungen, vorübergehende (teils schwere) Thrombozytopenie, Parästhesie, Schwindel, Benommenheit, Synkope, Durchfall, Granulom an der Einstichstelle, Müdigkeit, Asthenie, Okulomotoriusparese und Fazialisparese/Bell-Lähmung, Myalgie und Arthralgie im Nackenbereich, Durchfall
Tabelle 2: Nebenwirkungen der Impfstoffe FSME-IMMUN® Erwachsene (Pfizer, 2021a) und ENCEPUR Erwachsene (Deutsches Institut für Medizinische Dokumentation und Information, 2017a)
Kinder
FSME-IMMUN Junior®
ENCEPUR Kinder®
Sehr häufig (≥ 1/10)
Schmerzen an der Einstichstelle
Kopfschmerzen bei Kindern im Alter ab 3 Jahren, Schläfrigkeit bei Kindern im Alter von weniger als 3 Jahren, Schmerzen an der Injektionsstelle, Fieber > 38ºC bei Kindern im Alter von 1 bis 2 Jahren
Häufig (≥ 1/100 bis < 1/10)
Kopfschmerzen, Schwellung, Verhärtung und Rötung an der Injektionsstelle, Unwohlsein oder Erbrechen, verminderter Appetit, Müdigkeit und Unwohlsein, Unruhe, Schlafstörungen (bei jüngeren Kindern), Muskelschmerzen, Fieber
Übelkeit, Myalgie, Arthralgie, Fieber > 38ºC bei Kindern im Alter von 3 bis 11 Jahren, grippeähnliche Symptome (einschließlich Hyperhidrose, Rigor), Erythem, Ödem an der Injektionsstelle, Unwohlsein, Lethargie
Gelegentlich (≥ 1/1.000 bis < 1/100)
Lymphknotenschwellungen, Bauchschmerzen, Gelenkschmerzen, Schüttelfrost
Selten (≥ 1/10.000 bis < 1/1.000)
Juckreiz an der Impfstelle, Nesselsucht, anormale und verminderte Wahrnehmung wie Kribbeln oder Taubheitsgefühl entlang der Nervenbahnen, Benommenheit, Schwindel, Durchfall, Verdauungsstörungen
Ohne Angabe der Häufigkeit
allergische Reaktionen, entzündliche Erkrankungen des Gehirns, Zeichen vermehrter Reizbarkeit der Hirnhäute wie Nackensteifigkeit, neurologische Symptome wie Gesichtslähmungen, vollständige Lähmungen, Nervenentzündungen, Guillain-Barré-Syndrom, Sehverschlechterung, erhöhte Lichtempfindlichkeit, Augenschmerzen, Ohrenklingeln, Kurzatmigkeit, Hautreaktionen (Ausschlag und/oder Hautjucken), Hautrötung, verstärktes Schwitzen, Steifigkeit des Bewegungsapparats und Nackensteife/-schmerzen, Schmerzen in Armen und Beinen, grippeähnliche Erkrankung, Schwächegefühl, Hautschwellungen, unsicherer Gang, Krampfanfälle mit oder ohne Fieber
Lymphadenopathie, allergische Reaktionen (z. B. generalisierte Urtikaria, Erythema exsudativum multiforme, Anschwellen der Schleimhäute, Stridor, Dyspnoe, Bronchospasmus, Hypotonie und vorübergehende Thrombozytopenie), Parästhesie (z. B. Taubheit, Kribbeln), zerebrale Krampfanfälle (mit oder ohne Fieber), Synkope, Okulomotoriusparese und Fazialisparese/Bell-Lähmung, Myalgie und Arthralgie im Nackenbereich, Granulom an der Injektionsstelle, gelegentlich mit Serombildung
Tabelle 3: Nebenwirkungen der Impfstoffe FSME-IMMUN 0,25 ml Junior® (Pfizer, 2021b) und ENCEPUR Kinder® (Deutsches Institut für Medizinische Dokumentation und Information, 2017b)
Weiterführendes
- Die WHO empfiehlt in Regionen mit einer Inzidenz von 5 Fällen pro 100.000 Einwohnern eine flächendeckende Impfung ab dem Alter von einem Jahr (WHO, 2011).
- Für nicht-endemische Gebiete (Inzidenz <5/100.000) sollten nur Risikogruppen (z. B. >50 Jahre) geimpft werden (WHO, 2011).
- FSME: Die STIKO-Empfehlungen
Die Empfehlungen
Die STIKO empfiehlt Personen eine Impfung, die
- in Risikogebieten leben,
- durch die Arbeit exponiert sind oder
- in endemische Gebiete einreisen (s. Epidemiologisches Bulletin 14/2023).
Dabei gilt laut STIKO der Grundsatz: „Jede Impfung zählt.“
- Es solle nach Fachinformationen geimpft werden – eine angefangene Grundimmunisierung könne jedoch zu jedem Zeitpunkt fortgesetzt werden, d. h. die Grundimmunisierung müsse nicht erneut erfolgen, wenn die Auffrischungsimpfung erst Jahre nach dem empfohlenen Impfzeitpunkt verabreicht würde.
- Die Auffrischungsimpfung biete laut STIKO einen Schutz von 3 bis 5 Jahren.
- Die Saisonalität (April bis November) solle beachtet werden.
(Robert Koch-Institut, 2023a, 2023c)
Kritik an den STIKO-Empfehlungen
Die unterschiedliche Definition von Risikogebieten durch RKI und WHO führt zu unterschiedlichen Impfempfehlungen:
- Laut WHO sollten nur Risikogruppen in Regionen geimpft werden, in denen es ≥ 5 Fälle pro 100.000 Einwohner und Jahr gibt. Dagegen stützt sich die Impfempfehlung der STIKO auf die Definition des RKI (> 1 Erkrankung pro 100.000 Einwohner in einem der letzten 17 Fünfjahreszeiträume), wonach es sehr viel mehr Risikogebiete gibt (55:178) und die Impfung wesentlich mehr Personen mit zu hinterfragender Effektivität und Sinnhaftigkeit empfohlen wird.
- Das Alter spielt eine wichtige Rolle beim Impfzeitpunkt – ein systematisches Review von 2020 hat bestätigt, dass die humorale Immunreaktion signifikant geringer ist, wenn die Impfung im Alter von über 50 Jahren verabreicht wird. Ebenso verhält es sich mit immunsupprimierten Personen (Rampa et al., 2020). Darauf weist die STIKO in ihren Impfempfehlungen aber nicht hin (Robert Koch-Institut, 2023a).
- Insbesondere für Kinder und Jugendliche muss aufgrund des 10-fach geringeren Risikos für FSME sowie des Nebenwirkungsprofils der vorhandenen Impfstoffe eine individuelle Nutzen-Risiko-Abwägung stattfinden.
- Durch die Auffrischungsimpfung werden die Antikörperspiegel für 6 bzw. 8 Jahre stabil gehalten, sodass auch längere Zeiträume von bis zu 10 Jahren zwischen Grundimmunisierung und Booster sinnvoll sind.
- Die Impfung stellt nicht die einzige präventive Schutzmaßnahme vor FSME dar.
- Literaturverzeichnis
Blom, K., Cuapio, A., Sandberg, J. T., Varnaite, R., Michaëlsson, J., Björkström, N. K., Sandberg, J. K., Klingström, J., Lindquist, L., Gredmark Russ, S., & Ljunggren, H.-G. (2018). Cell-Mediated Immune Responses and Immunopathogenesis of Human Tick-Borne Encephalitis Virus-Infection. Frontiers in Immunology, 9, 2174. https://doi.org/10.3389/fimmu.2018.02174
Bublak, R. (2020). Medizin. CME (Berlin, Germany), 17(6), 36–37. https://doi.org/10.1007/s11298-020-7988-7
Bundeszentrale für gesundheitliche Aufklärung. (2023, April 21). FSME – Informationen über Krankheitserreger beim Menschen – Impfen schützt! infektionsschutz.de. https://www.infektionsschutz.de/erregersteckbriefe/fsme/
Chrdle, A., Chmelík, V., & Růžek, D. (2016). Tick-borne encephalitis: What travelers should know when visiting an endemic country. Human Vaccines & Immunotherapeutics, 12(10), 2694–2699. https://doi.org/10.1080/21645515.2016.1218098
Cook, M. J. (2015). Lyme borreliosis: A review of data on transmission time after tick attachment. International Journal of General Medicine, 8, 1–8. https://doi.org/10.2147/IJGM.S73791
Daniel, M., Danielová, V., Fialová, A., Malý, M., Kříž, B., & Nuttall, P. A. (2018). Increased Relative Risk of Tick-Borne Encephalitis in Warmer Weather. Frontiers in Cellular and Infection Microbiology, 8, 90. https://doi.org/10.3389/fcimb.2018.00090
Demicheli, V., Debalini, M. G., & Rivetti, A. (2009). Vaccines for preventing tick-borne encephalitis. The Cochrane Database of Systematic Reviews, 2009(1), CD000977. https://doi.org/10.1002/14651858.CD000977.pub2
Heuverswyn, J. V., Hallmaier-Wacker, L. K., Beauté, J., Dias, J. G., Haussig, J. M., Busch, K., Kerlik, J., Markowicz, M., Mäkelä, H., Nygren, T. M., Orlíková, H., Socan, M., Zbrzeźniak, J., Žygutiene, M., & Gossner, C. M. (2023). Spatiotemporal spread of tick-borne encephalitis in the EU/EEA, 2012 to 2020. Eurosurveillance, 28(11), 2200543. https://doi.org/10.2807/1560-7917.ES.2023.28.11.2200543
Kaiser, R. (2016). [Tick-borne encephalitis]. Der Nervenarzt, 87(6), 667–680. https://doi.org/10.1007/s00115-016-0134-9
Kollaritsch, H., Paulke-Korinek, M., Holzmann, H., Hombach, J., Bjorvatn, B., & Barrett, A. (2012). Vaccines and vaccination against tick-borne encephalitis. Expert Review of Vaccines, 11(9), 1103–1119. https://doi.org/10.1586/erv.12.86
Kubinski, M., Beicht, J., Gerlach, T., Volz, A., Sutter, G., & Rimmelzwaan, G. F. (2020). Tick-Borne Encephalitis Virus: A Quest for Better Vaccines against a Virus on the Rise. Vaccines, 8(3), 451. https://doi.org/10.3390/vaccines8030451
Kunz, C. (2003). TBE vaccination and the Austrian experience. Vaccine, 21, S50–S55. https://doi.org/10.1016/S0264-410X(02)00813-7
Nygren, T. M., Pilic, A., Böhmer, M. M., Wagner-Wiening, C., Wichmann, O., Harder, T., & Hellenbrand, W. (2022a). Tick-Borne Encephalitis Risk Increases with Dog Ownership, Frequent Walks, and Gardening: A Case-Control Study in Germany 2018-2020. Microorganisms, 10(4), 690. https://doi.org/10.3390/microorganisms10040690
Nygren, T. M., Pilic, A., Böhmer, M. M., Wagner-Wiening, C., Wichmann, O., Harder, T., & Hellenbrand, W. (2022b). Tick-borne encephalitis vaccine effectiveness and barriers to vaccination in Germany. Scientific Reports, 12(1), 11706. https://doi.org/10.1038/s41598-022-15447-5
Paul-Ehrlich-Institut. (2023, April 27). FSME-Impfstoffe. Arzneimittel – Impfstoffe. https://www.pei.de/DE/arzneimittel/impfstoffe/fsme/fsme-node.html
Paulke-Korinek, M., Rendi-Wagner, P., Kundi, M., Laaber, B., Wiedermann, U., & Kollaritsch, H. (2009). Booster vaccinations against tick-borne encephalitis: 6 years follow-up indicates long-term protection. Vaccine, 27(50), 7027–7030. https://doi.org/10.1016/j.vaccine.2009.09.068
Rabe, S. (2023, März 21). FSME-Risikogebiete—Weniger ist mehr? RKI vs. WHO... impf-info.de. https://www.impf-info.de/die-impfungen/fsme/311-fsme_who.html
Rampa, J. E., Askling, H. H., Lang, P., Zens, K. D., Gültekin, N., Stanga, Z., & Schlagenhauf, P. (2020). Immunogenicity and safety of the tick-borne encephalitis vaccination (2009-2019): A systematic review. Travel Medicine and Infectious Disease, 37, 101876. https://doi.org/10.1016/j.tmaid.2020.101876
Robert Koch-Institut. (2021). Infektionsepidemiologisches Jahrbuch meldepflichtiger Krankheiten für 2020. RKI, 2020. https://doi.org/10.25646/8773
Robert Koch-Institut. (2022a, April 21). Frühsommer-Meningoenzephalitis (FSME) und verwandte Virusenzephalitiden (TBE, tick-borne encephalitis). RKI-Ratgeber. https://www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_FSME.html
Robert Koch-Institut. (2022b, September 16). Antworten auf häufig gestellte Fragen zu Zecken, Zeckenstich, Infektion. RKI. https://www.rki.de/SharedDocs/FAQ/FSME/Zecken/Zecken.html#
Robert Koch-Institut. (2023a). Empfehlungen der Ständigen Impfkommission beim Robert Koch-Institut 2023. Epidemiologisches Bulletin, 4. https://doi.org/10.25646/10829
Robert Koch-Institut. (2023b). FSME-Risikogebiete in Deutschland. Epidemiologisches Bulletin 09/2023. https://doi.org/10.25646/11176
Robert Koch-Institut. (2023c). Empfehlungen der Ständigen Impfkommission (STIKO) und der Deutschen Gesellschaft für Tropenmedizin, Reisemedizin und Globale Gesundheit e.V. (DTG) zu Reiseimpfungen. Epidemiologisches Bulletin 14/2023, 14. https://www.rki.de/DE/Content/Infekt/EpidBull/Archiv/2023/Ausgaben/14_23.pdf?__blob=publicationFile
Ruzek, D., Avšič Županc, T., Borde, J., Chrdle, A., Eyer, L., Karganova, G., Kholodilov, I., Knap, N., Kozlovskaya, L., Matveev, A., Miller, A. D., Osolodkin, D. I., Överby, A. K., Tikunova, N., Tkachev, S., & Zajkowska, J. (2019). Tick-borne encephalitis in Europe and Russia: Review of pathogenesis, clinical features, therapy, and vaccines. Antiviral Research, 164, 23–51. https://doi.org/10.1016/j.antiviral.2019.01.014
Steffen, R. (2016). Epidemiology of tick-borne encephalitis (TBE) in international travellers to Western/Central Europe and conclusions on vaccination recommendations. Journal of Travel Medicine, 23(4), taw018. https://doi.org/10.1093/jtm/taw018
Wendt, S., Trawinski, H., von Braun, A., & Lübbert, C. (2019). Durch Zecken übertragbare Erkrankungen: Von der Lyme-Borreliose über das Q-Fieber bis zur FSME. CME (Berlin, Germany), 16(5), 53–71. https://doi.org/10.1007/s11298-019-6903-6
World Health Organization. (2011). Vaccines against tick-borne encephalitis: WHO position paper. Weekly Epidemiological Record, 24, 241–256.
World Health Organization. (2023). Tick-borne encephalitis. WHO Health Topics – Prevention. https://www.who.int/health-topics/tick-borne-encephalitis
Yoshii, K. (2019). Epidemiology and pathological mechanisms of tick-borne encephalitis. The Journal of Veterinary Medical Science, 81(3), 343–347. https://doi.org/10.1292/jvms.18-0373
Zens, K. D., Haile, S. R., Schmidt, A. J., Altpeter, E. S., Fehr, J. S., & Lang, P. (2022). Retrospective, matched case-control analysis of tickborne encephalitis vaccine effectiveness by booster interval, Switzerland 2006-2020. BMJ Open, 12(4), e061228. https://doi.org/10.1136/bmjopen-2022-061228
Stand: 3. Mai 2023
Nächste Aktualisierung: 3. Mai 2024

